题目内容
 (2012?通州区一模)某学习小组利用右图装置完成如下实验,以验证所学物质的性质.
(2012?通州区一模)某学习小组利用右图装置完成如下实验,以验证所学物质的性质.(1)若A中盛有浓盐酸,B中盛有紫色的石蕊试液,将A、B中液体分别滴入烧杯①、②中,一段时间后观察到的现象是
紫色的石蕊试液变红,气球变瘪
紫色的石蕊试液变红,气球变瘪
.(2)化学反应通常伴随能量的变化,可借助反应前后的温度变化来判断是否发生了反应.在不使用温度计的情况下,若A中盛有稀盐酸,烧杯①中盛有固体氢氧化钠,将A中的稀盐酸滴入烧杯①,观察到气球变瘪,则证明反应发生了.有的同学提出:该现象不足以证明NaOH与稀盐酸发生了化学反应.他的理由是:
固体氢氧化钠遇水放热,也可以使气球变瘪
固体氢氧化钠遇水放热,也可以使气球变瘪
.(填一种即可)(3)若将集气瓶中充满CO2,先将B中盛放的NaOH溶液滴入烧杯②中少量,会看到气球微微变鼓;再将A中的液体滴入烧杯①.请根据下列实验现象将下表中的试剂补充完整.
现象 装置 |
① 气球变瘪又恢复原状 |
② 气球变瘪 |
③ 气球先变瘪后又变得更鼓 |
| 滴管A | 浓硫酸 浓硫酸 |
稀盐酸或稀硫酸 稀盐酸或稀硫酸 |
H2O |
| 烧杯① | H2O | 固体Na2CO3 | 固体氢氧化钠或氧化钙 固体氢氧化钠或氧化钙 |
分析:(1)根据浓盐酸具有挥发性以及分子在不断的运动进行解答;
(2)根据固体氢氧化钠遇水放热进行解答;
(3)根据气球的变化是由于压强变大或变小而引起的进行解答.
(2)根据固体氢氧化钠遇水放热进行解答;
(3)根据气球的变化是由于压强变大或变小而引起的进行解答.
解答:解:(1)浓盐酸具有挥发性,挥发出氯化氢分子,氯化氢分子能使紫色的石蕊试液变红,由于压强变小,所以气球变瘪;
(2)该现象不足以证明NaOH与稀盐酸发生了化学反应.理由是固体氢氧化钠遇水放热,也可以使气球变瘪;
(3)根据浓硫酸溶于水放出热量,所以气球变瘪,等到温度降到室温,气球又恢复原状;稀盐酸或稀硫酸和碳酸钠反应生成二氧化碳,所以气球变瘪;固体氢氧化钠或氧化钙,溶于水放出大量的热,所以气球变瘪,当温度降到室温,气球变鼓,由于氢氧化钠或氢氧化钙会和二氧化碳反应,所以气球变得更鼓.
故答案为:(1)紫色的石蕊试液变红,气球变瘪;
(2)固体氢氧化钠遇水放热,也可以使气球变瘪;
(3)①浓硫酸;②稀盐酸或稀硫酸;③固体氢氧化钠或氧化钙.
(2)该现象不足以证明NaOH与稀盐酸发生了化学反应.理由是固体氢氧化钠遇水放热,也可以使气球变瘪;
(3)根据浓硫酸溶于水放出热量,所以气球变瘪,等到温度降到室温,气球又恢复原状;稀盐酸或稀硫酸和碳酸钠反应生成二氧化碳,所以气球变瘪;固体氢氧化钠或氧化钙,溶于水放出大量的热,所以气球变瘪,当温度降到室温,气球变鼓,由于氢氧化钠或氢氧化钙会和二氧化碳反应,所以气球变得更鼓.
故答案为:(1)紫色的石蕊试液变红,气球变瘪;
(2)固体氢氧化钠遇水放热,也可以使气球变瘪;
(3)①浓硫酸;②稀盐酸或稀硫酸;③固体氢氧化钠或氧化钙.
点评:解答本题关键要考虑气球鼓起的原因是压强增大,可能产生气体或溶于水放出热量,要熟记溶于水放热的常见物质.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
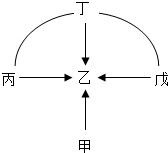 (2012?通州区一模)30、甲、乙、丙、丁、戊是初中化学常见的物质,其相互反应关系如图,“→”表示转化关系,“-”表示相互反应关系.请根据下列情况回答问题:
(2012?通州区一模)30、甲、乙、丙、丁、戊是初中化学常见的物质,其相互反应关系如图,“→”表示转化关系,“-”表示相互反应关系.请根据下列情况回答问题: