题目内容
(2012?通州区一模)某学习小组同学对已部分变质的氢氧化钠溶液中碳酸钠的含量进行测定.取50g样品溶液于烧杯中,加入足量氯化钡溶液,过滤、洗涤、干燥,得固体9.85g.
(1)用化学方程式表示氢氧化钠溶液变质的原因:
(2)求50g样品溶液中碳酸钠的质量.
(3)若用稀盐酸来测定氢氧化钠溶液中碳酸钠的含量,根据消耗盐酸的质量计算样品溶液中碳酸钠的质量,其结果会
(1)用化学方程式表示氢氧化钠溶液变质的原因:
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
.(2)求50g样品溶液中碳酸钠的质量.
(3)若用稀盐酸来测定氢氧化钠溶液中碳酸钠的含量,根据消耗盐酸的质量计算样品溶液中碳酸钠的质量,其结果会
偏高
偏高
(填“偏高”“不变”或“偏低”);你还可以用Ca(OH)2或Ba(OH)2
Ca(OH)2或Ba(OH)2
(填与氯化钡、盐酸不同类别物质的化学式)测定样品溶液中碳酸钠的质量.分析:(1)氢氧化钠变质是与二氧化碳反应再根据方程式的写法考虑;(2)根据过滤、洗涤、干燥,得固体9.85g属于碳酸钡的质量,计算出碳酸钠的质量;(3)根据与盐酸反应的物质不仅仅是碳酸钠,氢氧化钠也与其反应来考虑;根据与碳酸钠反应能生成沉淀,且不能是盐和酸.
解答:解:(1)氢氧化钠变质反应的反应物是氢氧化钠和二氧化碳,生成物是碳酸钠和水,用观察法配平即可,所以方程式是:2NaOH+CO2=Na2CO3+H2O
(2)设50g样品中碳酸钠的质量为x
Na2CO3+BaCl2=BaCO3↓+2NaCl
106 197
x 9.85 g
=
解得x=5.3 g
(3)与盐酸反应的物质不仅仅是碳酸钠,氢氧化钠也与其反应,所以误认为与盐酸反应的都是碳酸钠,所以把氢氧化钠也看成了碳酸钠,导致碳酸钠质量多了,所以结果偏高;与碳酸钠反应能生成沉淀,且不能是盐和酸,所以可以是碱,与碳酸根离子产生沉淀可以是钙离子或钡离子所以用 Ca(OH)2 或Ba(OH)2 就行.
故答案为:(1)2NaOH+CO2=Na2CO3+H2O;(2)5.3g;(3)偏高;Ca(OH)2 或Ba(OH)2.
(2)设50g样品中碳酸钠的质量为x
Na2CO3+BaCl2=BaCO3↓+2NaCl
106 197
x 9.85 g
| 106 |
| 197 |
| x |
| 9.85g |
(3)与盐酸反应的物质不仅仅是碳酸钠,氢氧化钠也与其反应,所以误认为与盐酸反应的都是碳酸钠,所以把氢氧化钠也看成了碳酸钠,导致碳酸钠质量多了,所以结果偏高;与碳酸钠反应能生成沉淀,且不能是盐和酸,所以可以是碱,与碳酸根离子产生沉淀可以是钙离子或钡离子所以用 Ca(OH)2 或Ba(OH)2 就行.
故答案为:(1)2NaOH+CO2=Na2CO3+H2O;(2)5.3g;(3)偏高;Ca(OH)2 或Ba(OH)2.
点评:解答本题关键是要知道过滤、洗涤、干燥,得固体9.85g属于碳酸钡的质量,再根据方程式进行进一步计算就行.

练习册系列答案
相关题目
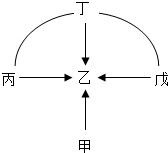 (2012?通州区一模)30、甲、乙、丙、丁、戊是初中化学常见的物质,其相互反应关系如图,“→”表示转化关系,“-”表示相互反应关系.请根据下列情况回答问题:
(2012?通州区一模)30、甲、乙、丙、丁、戊是初中化学常见的物质,其相互反应关系如图,“→”表示转化关系,“-”表示相互反应关系.请根据下列情况回答问题: