题目内容
7.空气是一种宝贵的资源.下列有关空气的说法正确的是( )| A. | 空气的主要成分是氧气,一切生命活动都离不开氧气 | |
| B. | 空气由氧气和氮气组成,其中氧气的质量约占空气质量的$\frac{1}{5}$ | |
| C. | 从空气中分离出的氮气化学性质不活泼,可作食品保鲜的保护气 | |
| D. | 空气质量报告中所列的空气质量级别数目越大,空气质量越好 |
分析 本题主要考查空气的成分及各成分的体积分数和空气对人类生活的作用,解答时要对照空气中各成分及作用,对每一个选项进行分析筛选.
解答 解:A、空气的主要成分是氮气,错误;
B、空气由氧气和氮气等多种气体组成,其中氧气的质量约占空气体积的$\frac{1}{5}$,错误;
C、从空气中分离出的氮气化学性质不活泼,可作食品保鲜的保护气,正确;
D、空气质量报告中所列的空气质量级别数目越大,空气质量越差,错误;
故选C
点评 本题不太难,但在选项中涉及各成分的体积比和成分对自然界和人类的作用,这样内容就显得很复杂,要学会分析,将知识适当拓展.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.同学们对制作糕点常用膨松剂Na2CO3或NaHCO3进行了下列探究.
【查阅资料】
表1
表2
【探究一】NaHCO3和Na2CO3性质差异的探究
(1)现有20℃时溶质质量分数为8%的Na2CO3和NaHCO3溶液酸碱性:取样于试管中,分别滴加紫色石蕊试液,均显蓝色;酸碱度:NaHCO3溶液<Na2CO3溶液(填“>”或”“<”).
(2)稳定性:按图1,实验中可观察乙烧杯中的石灰水变浑浊,对应试管中发生反应的化学方程式为:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
结论:在受热条件下,碳酸钠比碳酸氢钠稳定性强(填“强”或“弱”).
(3)利用溶解度鉴别NaHCO3和Na2CO3:分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察溶解现象来区分,X可以是下列的A.(选填A、B或C)
A.2g B.0.96g C.0.5g
【问题讨论】
(4)实验结束时,应先B(选填A或B).
A.熄灭酒精灯 B.将甲、乙烧杯移开
(5)甲认为探究稳定性实验中,由于受热时两物质温度不同,不能得到(2)中的结论,经对装置设计讨论后一致认为可以得到上述结论,理由是碳酸氢钠的受热温度低于碳酸钠的受热温度.
【探究二】测定NaHCO3和Na2CO3混合物10.0g中NaHCO3的质量分数(图2,夹持装置略)

【问题讨论】
(6)实验前先通一段时间的空气的目的是把装置中的二氧化碳排尽;
(7)A的作用是吸收空气中的二氧化碳,若没有装置E,NaHCO3的质量分数测定结果会偏大(填“偏大”、“不变”或“偏小”).
(8)停止加热后,仍继续通入空气一段时间,目的是把反应生成的二氧化碳完全排入D中.
【含量测定】
(9)测得装置D的质量实验前为122.2g,实验后为124.4g,计算该样品中NaHCO3的质量分.(要有计算过程)
【知识拓展】
(10)向Na2CO3溶液中通入CO2气体可以生成NaHCO3,该反应的化学反应方程式为:Na2CO3+CO2+H2O=2NaHCO3.
【查阅资料】
表1
| 20℃ | 8%Na2CO3溶液 | 8%NaHCO3溶液 |
| pH | 10.6 | 8.0 |
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
(1)现有20℃时溶质质量分数为8%的Na2CO3和NaHCO3溶液酸碱性:取样于试管中,分别滴加紫色石蕊试液,均显蓝色;酸碱度:NaHCO3溶液<Na2CO3溶液(填“>”或”“<”).
(2)稳定性:按图1,实验中可观察乙烧杯中的石灰水变浑浊,对应试管中发生反应的化学方程式为:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
结论:在受热条件下,碳酸钠比碳酸氢钠稳定性强(填“强”或“弱”).
(3)利用溶解度鉴别NaHCO3和Na2CO3:分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察溶解现象来区分,X可以是下列的A.(选填A、B或C)
A.2g B.0.96g C.0.5g
【问题讨论】
(4)实验结束时,应先B(选填A或B).
A.熄灭酒精灯 B.将甲、乙烧杯移开
(5)甲认为探究稳定性实验中,由于受热时两物质温度不同,不能得到(2)中的结论,经对装置设计讨论后一致认为可以得到上述结论,理由是碳酸氢钠的受热温度低于碳酸钠的受热温度.
【探究二】测定NaHCO3和Na2CO3混合物10.0g中NaHCO3的质量分数(图2,夹持装置略)

【问题讨论】
(6)实验前先通一段时间的空气的目的是把装置中的二氧化碳排尽;
(7)A的作用是吸收空气中的二氧化碳,若没有装置E,NaHCO3的质量分数测定结果会偏大(填“偏大”、“不变”或“偏小”).
(8)停止加热后,仍继续通入空气一段时间,目的是把反应生成的二氧化碳完全排入D中.
【含量测定】
(9)测得装置D的质量实验前为122.2g,实验后为124.4g,计算该样品中NaHCO3的质量分.(要有计算过程)
【知识拓展】
(10)向Na2CO3溶液中通入CO2气体可以生成NaHCO3,该反应的化学反应方程式为:Na2CO3+CO2+H2O=2NaHCO3.
2.化学课上,老师和同学们一起做了二氧化锰催化过氧化氢制取氧气的演示实验,实验后同学们的积极性依然很高.想知道氧化铜能否催化过氧化氢分解.请你和同学们一起完成探究:
(1)【提出问题】氧化铜能否作为氧化氢分解制氧气的催化剂?
(2)【猜想与假设】
①甲同学:氧化铜能做过氧化氢分解制氧气的催化剂;
②乙同学:氧化铜不能做过氧化氢分解制氧气的催化剂.
(3)【实验与结论】甲同学为了验证自己的猜想,设计以下实验进行验证:
请你帮忙填写上表中未填完的空格.
(4)在上述探究实验中,实验一和实验二起的作用是对照.
(1)【提出问题】氧化铜能否作为氧化氢分解制氧气的催化剂?
(2)【猜想与假设】
①甲同学:氧化铜能做过氧化氢分解制氧气的催化剂;
②乙同学:氧化铜不能做过氧化氢分解制氧气的催化剂.
(3)【实验与结论】甲同学为了验证自己的猜想,设计以下实验进行验证:
| 实验步驟 | 实验现象 | 实验结论或总结 | ||
| 各歩骤结论 | 总结 | |||
| 实验一 | 取10 mL 5%的过氧化氢溶液于一支试管中,用带火星的木条伸入试管,现察现象. | 试管中气泡很少,木条复燃 | 过氧化氢分解产生①氧气 | 氧化铜能作过氧化氢分解制氧气的催化剂 |
| 实验二 | 加热氧化铜粉末,用带火星的木条伸入试管,观察现象. | 木条不复燃 | 氧化铜受热 不产生氧气 | 氧化铜能作过氧化氢分解制氧气的催化剂 |
| 实验三 | 把一定质量的氧化铜粉末加入到装有②10 mL 5%的过氧化氢溶液的试管中,并用带火星的木条伸入试管,现察现象. | ③试管中气泡很多,木条复燃 | ④氧化铜加快了过氧化氢分解放出氧气的速率 | |
(4)在上述探究实验中,实验一和实验二起的作用是对照.
16.下列做法(或认识)有科学依据的是( )
| A. | 带上火把进入山洞进行科学探究 | |
| B. | 浴室煤气泄漏,立即打开排气扇 | |
| C. | 带上手电筒就放心进入久未开启的菜窖 | |
| D. | 洗衣服时,用硬水比软水效果更好 |
17.已知镁原子核内的质子数为12,且质子数和中子数相等,则下列结论错误的为( )
| A. | 中子数为12 | B. | 核外电子数为12 | ||
| C. | 核电荷数为12 | D. | 相对原子质量为36 |
 甲、乙、丙、丁是初中化学常见的化合物,甲是石灰石的主要成分,它们之间有如图所示的转化关系(部分物质和反应条件已略去).则丙的化学式为CaO;丙转化为丁的化学方程式为CaO+H2O═Ca(OH)2,写出乙的两种用途作灭火剂,气体肥料等.
甲、乙、丙、丁是初中化学常见的化合物,甲是石灰石的主要成分,它们之间有如图所示的转化关系(部分物质和反应条件已略去).则丙的化学式为CaO;丙转化为丁的化学方程式为CaO+H2O═Ca(OH)2,写出乙的两种用途作灭火剂,气体肥料等.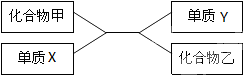 根据如图中化合物与单质相互转化的关系回答:
根据如图中化合物与单质相互转化的关系回答: 水是一种重要的自然资源.
水是一种重要的自然资源.