题目内容
海水是一种重要的自然资源,以下是某市对海水资源的部分利用.
(1)如图是从海水中提取镁的简单流程.

上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为________,由无水MgCl2制取Mg的化学方程式为________.
(2)如图是海水“制碱”的部分简单流程.

步骤Ⅲ、步骤Ⅳ反应的化学方程式为:________、________.
解:(1)沉淀B与试剂C发生的是中和反应,则沉淀B是氢氧化镁.故填:Mg(OH)2;
由无水MgCl2制取Mg的化学方程式为:MgCl2 Mg+Cl2↑.
Mg+Cl2↑.
(2)前三个步骤加入的物质有氯化钠、氨气、二氧化碳、水,这些是反应物,生成物是碳酸氢钠,由于碳酸氢钠溶解度较小,易结晶析出,应看作沉淀,方程式为:NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl;步骤Ⅳ是碳酸氢钠受热分解生成碳酸钠、水、二氧化碳,反应的化学方程式为2NaHCO3 Na2CO3+H2O+CO2↑.
Na2CO3+H2O+CO2↑.
故答案为:
(1)Mg(OH)2;MgCl2 Mg+Cl2↑.
Mg+Cl2↑.
(2)NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl;2NaHCO3 Na2CO3+H2O+CO2↑.
Na2CO3+H2O+CO2↑.
分析:(1)沉淀B与试剂C发生的是中和反应,则沉淀B是氢氧化镁,根据反应物和生成物及其质量守恒定律可以正确的书写化学方程式;
(2)根据前三个步骤加入的物质判断反应物和生成物,再写出步骤Ⅲ、Ⅳ的方程式.
点评:化学来源于生产、生活,又服务于生产、生活,氨碱工业是初中化学重要的应用之一,是考查重点,常涉及化学方程式的书写.
由无水MgCl2制取Mg的化学方程式为:MgCl2
 Mg+Cl2↑.
Mg+Cl2↑.(2)前三个步骤加入的物质有氯化钠、氨气、二氧化碳、水,这些是反应物,生成物是碳酸氢钠,由于碳酸氢钠溶解度较小,易结晶析出,应看作沉淀,方程式为:NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl;步骤Ⅳ是碳酸氢钠受热分解生成碳酸钠、水、二氧化碳,反应的化学方程式为2NaHCO3
 Na2CO3+H2O+CO2↑.
Na2CO3+H2O+CO2↑.故答案为:
(1)Mg(OH)2;MgCl2
 Mg+Cl2↑.
Mg+Cl2↑.(2)NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl;2NaHCO3
 Na2CO3+H2O+CO2↑.
Na2CO3+H2O+CO2↑.分析:(1)沉淀B与试剂C发生的是中和反应,则沉淀B是氢氧化镁,根据反应物和生成物及其质量守恒定律可以正确的书写化学方程式;
(2)根据前三个步骤加入的物质判断反应物和生成物,再写出步骤Ⅲ、Ⅳ的方程式.
点评:化学来源于生产、生活,又服务于生产、生活,氨碱工业是初中化学重要的应用之一,是考查重点,常涉及化学方程式的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 自然界的碳氧循环如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图回答有关问题:
自然界的碳氧循环如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图回答有关问题:
 自然界的碳氧循环如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图回答有关问题:
自然界的碳氧循环如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图回答有关问题: C6H12O6(葡萄糖)+3O2,生成的葡萄糖供植物生长.则光合作用为植物生长提供的元素有______.
C6H12O6(葡萄糖)+3O2,生成的葡萄糖供植物生长.则光合作用为植物生长提供的元素有______.
 CO2
CO2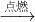 二氧化碳+水
二氧化碳+水 Na 2CO3+H2O+CO2↑
Na 2CO3+H2O+CO2↑