题目内容
(2009?常熟市模拟)完成下列反应的化学方程式,并回答有关问题.(1)除掉部分变质的氢氧化钠溶液中的杂质:______,该反应属于______反应类型.
(2)能提供人体所需活动能量的主要物质是______(填名称),它在体内发生缓慢氧化的化学方程式是______.
(3)钢铁厂用一氧化碳还原赤铁矿(主要成分三氧化二铁)炼铁:______ 2Fe+3CO2
【答案】分析:(1)①氢氧化钠溶液变质后就是碳酸钠,氢氧化钙可以和碳酸钠发生反应,生成碳酸钙沉淀.故要除掉部分变质的氢氧化钠溶液中的杂质,可以加入Ca(OH)2溶液,过滤出反应生成的CaCO3;
②由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应.故以上反应属于复分解反应;
(2)碳水化合物是人类获取能量最经济和最主要的来源,占所需总能量的55-65%.糖原和肝糖原是碳水化合物的储存形式,肌体一旦需要(如跑步),糖原就能分解为葡萄糖进行氧化后产生能量;每克葡萄糖在体内氧化可产生4千卡能量.据此答题;
(3)①用一氧化碳还原赤铁矿,生成铁和二氧化碳,写出化学方程式即可;
②置换反应是单质与化合物反应生成另外的单质和化合物的化学反应.因为CO是化合物,不是单质,故该反应不是置换反应;
(4)家里燃烧天然气,是天然气与氧气发生反应的过程,据此写出化学方程式;
(5)①氢氧化亚铁在氧气和水的作用下生成氢氧化铁,就是氢氧化亚铁与氧气和水发生反应的过程,据此写出化学方程式;
②氢氧化铁固体的颜色是红褐色,一般有关铁的化合物,无论是盐还是碱还是氧化物,都是差不多这样的颜色,就是我们俗称的铁锈红.
解答:答:(1)①氢氧化钙与碳酸钠反应的化学方程式为:Ca(OH)2+Na2CO3=2NaOH+CaCO3↓;
②以上反应符合复分解反应的特点,故以上反应属于复分解反应;
(2)①碳水化合物是人类获取能量最经济和最主要的来源,每克葡萄糖在体内氧化可产生4千卡能量.
②它在体内发生缓慢氧化的化学方程式是C6H12O6+6O2=6CO2+6H2O;
(3)①一氧化碳还原赤铁矿(主要成分三氧化二铁)炼铁的化学方程式为:3CO+Fe2O3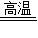 2Fe+3CO2;
2Fe+3CO2;
②因为CO是化合物,不是单质,该反应不是单质与化合物反应,故该反应不是置换反应;
(4)家里燃烧天然气的化学方程式为:CH4+O2 CO2+H2O;
CO2+H2O;
(5)①氢氧化亚铁在氧气和水的作用下生成氢氧化铁的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②氢氧化铁固体的颜色是红褐色.
故答案为:(1)Ca(OH)2+Na2CO3=2NaOH+CaCO3↓,复分解;
(2)葡萄糖,C6H12O6+6O2=6CO2+6H2O;
(3)3CO+Fe2O3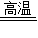 2Fe+3CO2,不是;
2Fe+3CO2,不是;
(4)CH4+O2 CO2+H2O;
CO2+H2O;
(5)4Fe(OH)2+O2+2H2O=4Fe(OH)3,红褐色.
点评:本题主要考查学生正确书写化学方程式的能力.
②由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应.故以上反应属于复分解反应;
(2)碳水化合物是人类获取能量最经济和最主要的来源,占所需总能量的55-65%.糖原和肝糖原是碳水化合物的储存形式,肌体一旦需要(如跑步),糖原就能分解为葡萄糖进行氧化后产生能量;每克葡萄糖在体内氧化可产生4千卡能量.据此答题;
(3)①用一氧化碳还原赤铁矿,生成铁和二氧化碳,写出化学方程式即可;
②置换反应是单质与化合物反应生成另外的单质和化合物的化学反应.因为CO是化合物,不是单质,故该反应不是置换反应;
(4)家里燃烧天然气,是天然气与氧气发生反应的过程,据此写出化学方程式;
(5)①氢氧化亚铁在氧气和水的作用下生成氢氧化铁,就是氢氧化亚铁与氧气和水发生反应的过程,据此写出化学方程式;
②氢氧化铁固体的颜色是红褐色,一般有关铁的化合物,无论是盐还是碱还是氧化物,都是差不多这样的颜色,就是我们俗称的铁锈红.
解答:答:(1)①氢氧化钙与碳酸钠反应的化学方程式为:Ca(OH)2+Na2CO3=2NaOH+CaCO3↓;
②以上反应符合复分解反应的特点,故以上反应属于复分解反应;
(2)①碳水化合物是人类获取能量最经济和最主要的来源,每克葡萄糖在体内氧化可产生4千卡能量.
②它在体内发生缓慢氧化的化学方程式是C6H12O6+6O2=6CO2+6H2O;
(3)①一氧化碳还原赤铁矿(主要成分三氧化二铁)炼铁的化学方程式为:3CO+Fe2O3
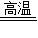 2Fe+3CO2;
2Fe+3CO2;②因为CO是化合物,不是单质,该反应不是单质与化合物反应,故该反应不是置换反应;
(4)家里燃烧天然气的化学方程式为:CH4+O2
 CO2+H2O;
CO2+H2O;(5)①氢氧化亚铁在氧气和水的作用下生成氢氧化铁的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②氢氧化铁固体的颜色是红褐色.
故答案为:(1)Ca(OH)2+Na2CO3=2NaOH+CaCO3↓,复分解;
(2)葡萄糖,C6H12O6+6O2=6CO2+6H2O;
(3)3CO+Fe2O3
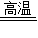 2Fe+3CO2,不是;
2Fe+3CO2,不是;(4)CH4+O2
 CO2+H2O;
CO2+H2O;(5)4Fe(OH)2+O2+2H2O=4Fe(OH)3,红褐色.
点评:本题主要考查学生正确书写化学方程式的能力.

练习册系列答案
相关题目
(2009?常熟市模拟)(本题有a、b两小题,考生任选一题解答,不得两题都解.若两题都解,则以a小题计分)
a.实验室里同学们要配制一定溶质质量分数的氯化钙溶液.药品柜中可供选择的药品只有氢氧化钙、氧化钙、碳酸钙和硝酸钙四种固体及一定溶质质量分数的稀盐酸.同学们交流讨论后,选择了一种固体药品并称取15g加入烧杯中,再向其中加入105.4g稀盐酸,充分反应后过得到5g固体和111 g氯化钙溶液(实验中物质损耗忽略不计),并将上述配好的氯化钙溶液倒入贴有相应标签的试剂瓶中.请回答下列问题:
(1)同学们选择的固体药品是______;
(2)请写出题中发生反应的化学方程式______;
(3)请根据已知条件求解生成氯化钙质量______g.
b.现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一种,现欲测定其组成.
[查阅资料]Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn-119,Ni-59.
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
试求:①合金中铜的质量分数为______.②合金中另一金属是______.
a.实验室里同学们要配制一定溶质质量分数的氯化钙溶液.药品柜中可供选择的药品只有氢氧化钙、氧化钙、碳酸钙和硝酸钙四种固体及一定溶质质量分数的稀盐酸.同学们交流讨论后,选择了一种固体药品并称取15g加入烧杯中,再向其中加入105.4g稀盐酸,充分反应后过得到5g固体和111 g氯化钙溶液(实验中物质损耗忽略不计),并将上述配好的氯化钙溶液倒入贴有相应标签的试剂瓶中.请回答下列问题:
(1)同学们选择的固体药品是______;
(2)请写出题中发生反应的化学方程式______;
(3)请根据已知条件求解生成氯化钙质量______g.
b.现一块铜合金,可能是黄铜(铜锌合金)、青铜(铜、锡合金)、白铜[铜、镍(Ni)合金]中的一种,现欲测定其组成.
[查阅资料]Ⅰ.锌、锡、镍皆能与稀硫酸发生置换反应,生成+2价的金属离子;
Ⅱ.相对原子质量Zn-65,Sn-119,Ni-59.
[实验步骤及数据]取5g合金粉碎后放入烧杯中,将20g15%稀H2SO4分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
| 次数 | 1 | 2 | 3 | 4 |
| 加入酸的质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |

