题目内容
某同学为了测定一种保健食品中CaCO3的质量分数,进行了如下实验:将200片该食品放入一烧杯中,再向其中注入400g足量的稀盐酸,直到不再产生气泡时,测得烧杯内剩余物质的总质量为473.6g.请你根据以上数据计算.

(1)该保健食品中CaCO3的质量分数(该保健食品中其他成分不与稀盐酸反应)
(2)所用盐酸的溶质质量分数.
解:(1)根据质量守恒定律可知生成二氧化碳的质量为:400g+100g-473.6g=26.4g
设参与反应的碳酸钙的质量为 Xg
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
X Y 26.4
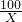 =
= 解得 X=60g
解得 X=60g
该保健食品中CaCO3的质量分数= ×100%=60%;
×100%=60%;
(2)设 参与反应的盐酸的质量为Y g,则
 =
= 解得 Y=43.8 g
解得 Y=43.8 g
盐酸的溶质质量分数= ×100%=10.95%
×100%=10.95%
答:该保健食品中CaCO3的质量分数为60%;
(2)所用盐酸的溶质质量分数10.95%.
分析:(1)根据质量守恒定律,求出生成二氧化碳的质量;据此再求出参与反应的碳酸钙的质量,然后求出该保健食品中CaCO3的质量分数;
(2)根据生成二氧化碳的质量求出,参与反应的盐酸的质量,然后求所用盐酸的溶质质量分数.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
设参与反应的碳酸钙的质量为 Xg
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
X Y 26.4
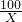 =
= 解得 X=60g
解得 X=60g该保健食品中CaCO3的质量分数=
 ×100%=60%;
×100%=60%;(2)设 参与反应的盐酸的质量为Y g,则
 =
= 解得 Y=43.8 g
解得 Y=43.8 g盐酸的溶质质量分数=
 ×100%=10.95%
×100%=10.95% 答:该保健食品中CaCO3的质量分数为60%;
(2)所用盐酸的溶质质量分数10.95%.
分析:(1)根据质量守恒定律,求出生成二氧化碳的质量;据此再求出参与反应的碳酸钙的质量,然后求出该保健食品中CaCO3的质量分数;
(2)根据生成二氧化碳的质量求出,参与反应的盐酸的质量,然后求所用盐酸的溶质质量分数.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
牙膏是生活必需品,某兴趣小组同学对某品牌市售牙膏展开如下探究,请回答问题:
[资料卡片]:
a、SiO2不溶于水、且不与酸反应,高温不分解;
b、NaHCO3受热易分解,生成Na2CO3、H2O、CO2;
c、牙膏中保湿剂、增稠剂、香精等均为有机物.
(1)取一小段牙膏,加入蒸馏水,充分搅拌后静置,测得其上层清液的pH为8.3,则此牙膏显 性,实验室能否用pH试纸测得该数值,请你作出判断并说明理由. ;
(2)小岳同学发现,此品牌牙膏在冬季会出现颗粒变大的现象.资料显示是牙膏中的K12(一种钠盐)析出,则K12的溶解度和温度的关系是 ;
(3)为测定此牙膏中SiO2的质量分数,兴趣小组同学设计了如下方案,并进行了3次实验:
[实验步骤]:
①准确称取2.0g牙膏膏体,烘干水分,高温加热,至质量不再减轻为止,在干燥器中冷却至室温;
②转移剩余物至烧杯中,加入稀HCl,至 ;
③过滤、洗涤、称量得到剩余固体质量(如表);
④根据实验数据进行计算.
[数据处理]:
(4)此测定做3次实验的目的是 ;
(5)综合上述实验方案及实验数据,计算此牙膏中SiO2的质量分数. ;
[实验分析]:
(6)按上述实验步骤操作,发现测定结果偏大,导致偏大的原因可能是 ;
(7)高温加热的目的除为了除去CaCO3及NaHCO3以外,还为除去 ;
(8)步骤②中,加稀HCl发生的反应有 、 ;
(9)步骤③中,洗涤的目的是 ;若不洗涤,则测定结果将 .(填“偏大”、“偏小”或“不变”)
(10)为保证洗涤效果,最好用 洗涤.
A.蒸馏水 B.自来水 C.饱和NaCl溶液 D.饱和CaCl2溶液.
 | 配料表 |
| 摩擦剂:SiO2(20%) CaCO3(少量) 清洁剂:NaHCO3(15%) 发泡剂:K12(极少量) 保湿剂:甘油等(60%) 增稠剂:卡拉胶等 其他:香精、水等 |
a、SiO2不溶于水、且不与酸反应,高温不分解;
b、NaHCO3受热易分解,生成Na2CO3、H2O、CO2;
c、牙膏中保湿剂、增稠剂、香精等均为有机物.
(1)取一小段牙膏,加入蒸馏水,充分搅拌后静置,测得其上层清液的pH为8.3,则此牙膏显 性,实验室能否用pH试纸测得该数值,请你作出判断并说明理由. ;
(2)小岳同学发现,此品牌牙膏在冬季会出现颗粒变大的现象.资料显示是牙膏中的K12(一种钠盐)析出,则K12的溶解度和温度的关系是 ;
(3)为测定此牙膏中SiO2的质量分数,兴趣小组同学设计了如下方案,并进行了3次实验:
[实验步骤]:
①准确称取2.0g牙膏膏体,烘干水分,高温加热,至质量不再减轻为止,在干燥器中冷却至室温;
②转移剩余物至烧杯中,加入稀HCl,至 ;
③过滤、洗涤、称量得到剩余固体质量(如表);
| 实验编号 | 1 | 2 | 3 |
| 实验前(g) | 2.00 | 2.00 | 2.00 |
| 实验后(g) | 0.43 | 0.44 | 0.45 |
[数据处理]:
(4)此测定做3次实验的目的是 ;
(5)综合上述实验方案及实验数据,计算此牙膏中SiO2的质量分数. ;
[实验分析]:
(6)按上述实验步骤操作,发现测定结果偏大,导致偏大的原因可能是 ;
(7)高温加热的目的除为了除去CaCO3及NaHCO3以外,还为除去 ;
(8)步骤②中,加稀HCl发生的反应有 、 ;
(9)步骤③中,洗涤的目的是 ;若不洗涤,则测定结果将 .(填“偏大”、“偏小”或“不变”)
(10)为保证洗涤效果,最好用 洗涤.
A.蒸馏水 B.自来水 C.饱和NaCl溶液 D.饱和CaCl2溶液.
