题目内容
为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反应后用天平称量,几率试验数据如下:
请回答下列问题并计算:
(1)经分析,在第1次实验结束后,反应物 全反应完了.
(2)50g样品与 克稀硫酸恰好完全反应,生成气体 克.
(3)计算样品中锌的质量分数为.(写出具体的计算过程)
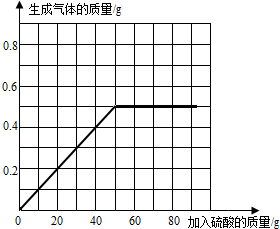
(4)请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系.

| 试验次序 | 第1次 | 第2次 | 第3次 | 第4次 |
| 所取质量/g | 50.0 | 50.0 | 50.0 | 50.0 |
| 加入稀硫酸质量/g | 20.0 | 40.0 | 60.0 | 80.0 |
| 生成气体质量/g | 0.2 | 0.4 | 0.5 | 0.5 |
(1)经分析,在第1次实验结束后,反应物
(2)50g样品与
(3)计算样品中锌的质量分数为.(写出具体的计算过程)
(4)请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系.
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:根据表中提供的数据可以判断样品和稀硫酸反应的进行情况;
根据生成氢气的质量可以计算锌的质量,进一步可以计算样品中锌的质量分数;
根据提供的数据可以判断加入稀硫酸的质量与生成气体的质量关系.
根据生成氢气的质量可以计算锌的质量,进一步可以计算样品中锌的质量分数;
根据提供的数据可以判断加入稀硫酸的质量与生成气体的质量关系.
解答:解:(1)根据第1、2、3次实验数据可知,在第1次实验结束后,反应物硫酸全反应完了.
故填:硫酸.
(2)由第1、2次实验数据可知,反应的稀硫酸的质量和生成氢气的质量比是10:0.1,生成氢气的质量是0.5g,则50g样品与50克稀硫酸恰好完全反应.
故填:50;0.5.
(3)设锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑,
65 2
x 0.5g
=
,
x=16.25g,
样品中锌的质量分数为:
×100%=32.5%,
答:样品中锌的质量分数为32.5%.
(4)加入稀硫酸的质量与生成气体的质量比为:20g:0.2g=100:1,图象如下图所示:
故填:硫酸.
(2)由第1、2次实验数据可知,反应的稀硫酸的质量和生成氢气的质量比是10:0.1,生成氢气的质量是0.5g,则50g样品与50克稀硫酸恰好完全反应.
故填:50;0.5.
(3)设锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑,
65 2
x 0.5g
| 65 |
| x |
| 2 |
| 0.5g |
x=16.25g,
样品中锌的质量分数为:
| 16.25g |
| 50.0g |
答:样品中锌的质量分数为32.5%.
(4)加入稀硫酸的质量与生成气体的质量比为:20g:0.2g=100:1,图象如下图所示:

点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
在实验报告中有以下实验数据与操作,其中正确的是( )
| A、用托盘天平称取11.02g食盐 |
| B、用100mL量筒量取8.2mL水 |
| C、用托盘天平称取8.2g胆矾 |
| D、用量筒量取11.02mL盐酸 |
欲量取8.2mL稀盐酸,最好选用的仪器是( )
①5mL量筒?②10mL量筒?③50mL量筒?④胶头滴管.
①5mL量筒?②10mL量筒?③50mL量筒?④胶头滴管.
| A、①④ | B、?② |
| C、③④? | D、?②④? |
下列物质的名称或分类有错误的是( )
| A、NaOH[纯碱、碱] |
| B、KAl(SO4)2?12H2O[明矾、盐] |
| C、HCl[氢氯酸、酸] |
| D、CaO[生石灰、氧化物] |
做好环境消毒是预防甲型H1N1流感的有效措施,过氧乙酸(CH3COOOH)是常用的消毒剂之一.下列有关过氧乙酸的说法不正确的是( )
| A、过氧乙酸由两个碳原子、四个氢原子、三个氧原子构成 |
| B、过氧乙酸由碳、氢、氧三种元素组成 |
| C、过氧乙酸中碳、氢、氧的原子个数比为2:4:3 |
| D、19%的过氧乙酸溶液中氧元素的质量分数为84% |

