题目内容
【题目】为了测定混有少量杂质的高锰酸钾固体样品中高锰酸钾的质量分数,取10g样品加热(杂质不反应),剩余固体质量(纵坐标)与加热时间(横坐标)的关系如下图所示:

(1)t0至t1时间段,固体质量不变的原因是__________。
(2)求样品中高锰酸钾的质量分数是多少_________?(写出计算过程)
【答案】刚刚开始加热未达到高锰酸钾的分解温度.(高锰酸钾还未开始分解或反应也可以) 79%
【解析】
(1)t0至t1时间段,固体质量不变的原因是刚刚开始加热未达到高锰酸钾的分解温度。
故填:刚刚开始加热未达到高锰酸钾的分解温度。
(2)由质量守恒定律可知,反应中减少的质量就是生成氧气的质量,反应中产生氧气的质量是:10g-9.2g=0.8g。
设样品中KMnO4质量为x。

x=7.9g
样品中KMnO4质量分数为![]() × 100%=79%
× 100%=79%
答:样品中KMnO4质量分数为79%。

 名校课堂系列答案
名校课堂系列答案【题目】乙醇俗称酒精,可用作医用消毒,也常作燃料。其完全燃烧的化学方程式可表示为:C2H6O+3O2![]() 2 CO2+ 3 H2O 。
2 CO2+ 3 H2O 。
23g乙醇完全燃烧需消耗多少克氧气?
乙醇不完全燃烧会产生一氧化碳,某实验测得反应前后各物质的质量如下表:
物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量(g) | 4.6 | 8.8 | 0 | 0 | 0 |
反应后质量(g) | 0 | 0 | 6.6 | 5.4 | a |
①表中a的值为____ __。
②该实验发生反应的化学方程式为:4C2H6O+11O2![]() _____ CO2+ _____ H2O + _____ CO 。
_____ CO2+ _____ H2O + _____ CO 。
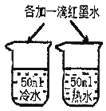
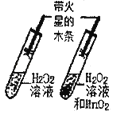
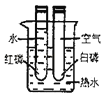
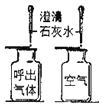
【题目】对比实验是实验探究的重要方法,下列对比实验设计不能实现相应实验目的是( )
实验设计 |
|
|
|
|
选项 | A探究温度对分子运动快慢的影响 | B探究MnO2能否加H2O2分解 | C.探究空气是燃烧的必要条件 | D.探究空气、呼出气体中CO2含量 |
A. A B. B C. C D. D