题目内容
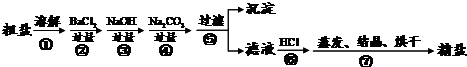
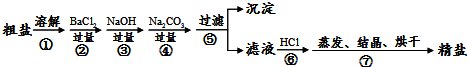
23、通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质.以下是制备精盐的实验方案,各步操作流程如下:

(1)在第①步粗盐溶解操作中要用
(2)第②步操作的目的是除去粗盐中的
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是

(1)在第①步粗盐溶解操作中要用
玻璃棒
搅拌,作用是
加快粗盐溶解
.(2)第②步操作的目的是除去粗盐中的
Na2SO4
(填化学式,下同),第⑥步操作的目的是除去滤液中的
NaOH、Na2CO3
.(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、
CaCO3、BaCO3
(填化学式).(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是
会引入新杂质KCl
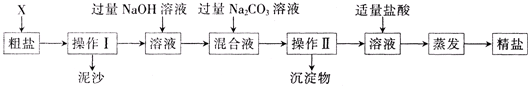
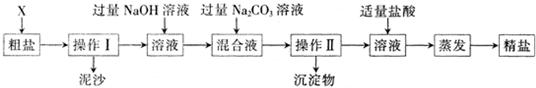
.分析:粗盐中的MgCl2、CaCl2、Na2SO4都溶于水,要想将杂质除去必须将MgCl2、CaCl2和Na2SO4转化为沉淀,连同泥沙一起过滤除去.
解答:解:本实验的过程为;①粗盐提纯的第一步是溶解,搅拌时要用到玻璃棒,以加快粗盐溶解.
②加入过量BaCl2溶液,与Na2SO4发生反应,生成BaSO4沉淀和NaCl;
③加过量NaOH溶液,与MgCl2发生反应,生成Mg(OH)2沉淀和氯化钠;
④加过量Na2CO3溶液,与CaCl2和①中过量BaCl2溶液发生反应,生成CaCO3沉淀和BaCO3沉淀和氯化钠;
⑤过滤,滤出前面生成的沉淀及泥沙;
⑥加适量盐酸,与③中过量NaOH溶液和②中过量Na2CO3溶液发生反应,生成氯化钠、水和二氧化碳气体.
⑦蒸发、结晶,得到精盐.
故答案为:(1)玻璃棒,加快粗盐溶解;
(2)Na2SO4,NaOH、Na2CO3;
(3)CaCO3、BaCO3;
(4)会引入新杂质KCl.
②加入过量BaCl2溶液,与Na2SO4发生反应,生成BaSO4沉淀和NaCl;
③加过量NaOH溶液,与MgCl2发生反应,生成Mg(OH)2沉淀和氯化钠;
④加过量Na2CO3溶液,与CaCl2和①中过量BaCl2溶液发生反应,生成CaCO3沉淀和BaCO3沉淀和氯化钠;
⑤过滤,滤出前面生成的沉淀及泥沙;
⑥加适量盐酸,与③中过量NaOH溶液和②中过量Na2CO3溶液发生反应,生成氯化钠、水和二氧化碳气体.
⑦蒸发、结晶,得到精盐.
故答案为:(1)玻璃棒,加快粗盐溶解;
(2)Na2SO4,NaOH、Na2CO3;
(3)CaCO3、BaCO3;
(4)会引入新杂质KCl.
点评:本题主要考查学生对粗盐提纯实验操作的熟练程度.

练习册系列答案
相关题目
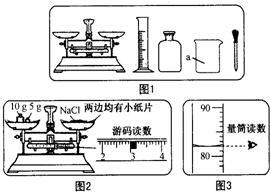 某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验:
某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验: