题目内容
6. 酸、碱、盐是化学学习的重要内容,请回答下列问题:
酸、碱、盐是化学学习的重要内容,请回答下列问题:(1)下列有关酸、碱、盐的说法中错误的是A(填字母代号)
A,酸中一定含有氧元素 B.碱中一定含有氢元素 C.盐中不一定含有金属元素 D.纯碱一定不属于碱类
(2)如图是某硫酸标签上的部分内容,取50mL该硫酸可配制成溶质质量分数为9.8%的稀硫酸溶液920g,若量取硫酸时俯视量筒读数,则所得溶液的质量分数偏小(填“偏大”、“偏小”或“不变”)
(3)氢氧化钠是一种常见的碱
①由于氢氧化钠固体在空气中会出现潮解现象,故可做干燥剂
②氢氧化钠在工业上通常用电解饱和食盐水的方法制取,产物除氢氧化钠外,还有H2和Cl2,请写出电解饱和食盐水的化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
(4)为除去某食盐溶液中含有少量的CaCl2、MgCl2和Na2SO4等可溶性杂质,依次进行如下操作:a加入过量的氢氧化钡溶液,b.加入过量的碳酸钠溶液,c.过滤,d.用稀盐酸调节滤液pH=7
①写出过滤所得滤液中含有的溶质成分
②调节滤液pH=7时不能使用稀硫酸代替稀盐酸的原因是什么?
③为测定最后所得溶液中氯化钠的溶质质量分数,取10g该溶液,向其中滴加足量硝酸银溶液,充分反应后,经过滤、洗涤、烘干,得到2.87g沉淀,请计算该溶液中氯化钠的溶质质量分数.
分析 (1)根据酸碱盐的定义分析选择;
(2)溶液稀释过程中溶质的质量不变;分析误差可能产生的原因;
(3)根据氢氧化钠的用途分析对应的性质,根据给出的信息书写对应的化学方程式;
(4)根据食盐除杂的叙述分析解答和计算.
解答 解:
(1)
A,酸由含氧酸(硫酸、硝酸、碳酸等)和无氧酸(盐酸、氢硫酸、氢氟酸等),所以酸不一定含有氧元素.错误;
B.碱是含有金属离子和氢氧根离子的化合物,所以碱中一定含有氢元素.正确;
C.盐中不一定含有金属元素,如硝酸铵、硫酸铵、碳酸铵和;氯化铵等.正确;
D.纯碱是盐而非碱,所以一定不属于碱类.正确.
故选:A.
(2)如图是某硫酸标签上的部分内容,取50mL该硫酸所含溶质的质量为50mL×1.84g/cm3×98%,可配制成溶质质量分数为9.8%的稀硫酸溶液为50mL×1.84g/cm3×98%÷9.8%=920g,若量取硫酸时俯视量筒读数,导致浓硫酸量取的偏少,则所得溶液的质量分数偏小.
(3)①由于氢氧化钠固体可做干燥剂,也就是吸水,所以对应的性质是氢氧化钠固体具有吸水性,在露置空气中会出现潮解现象.
②氢氧化钠在工业上通常用电解饱和食盐水的方法制取,产物除氢氧化钠外,还有H2和Cl2,对应的化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑.
(4)为除去某食盐溶液中含有少量的CaCl2、MgCl2和Na2SO4等可溶性杂质,依次进行如下操作:a加入过量的氢氧化钡溶液,b.加入过量的碳酸钠溶液,c.过滤,d.用稀盐酸调节滤液pH=7
①过滤所得滤液中含有的溶质成分是本来存在的氯化钠和生成的氯化钠以及过量的碳酸钠以及生成的氢氧化钠,所以溶质为氯化钠和碳酸钠和氢氧化钠.
②调节滤液pH=7时不能使用稀硫酸代替稀盐酸,因为最终要得到氯化钠,所以为避免引入新的杂质而不能使用硫酸.
③设生成2.87g氯化银沉淀消耗的氯化钠的质量为x
AgNO3+NaCl=NaNO3+AgCl↓
58.5 143.5
x 2.87g
$\frac{58.5}{143.5}$=$\frac{x}{2.87g}$
x=1.17g
该溶液中氯化钠的溶质质量分数为$\frac{1.17g}{10g}$×100%=11.7%
故答案为:
(1)A;
(2)920; 偏小;
(3)①潮解;②2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+H2↑+Cl2↑
(4)①氯化钠、氢氧化钠、碳酸钠;
②避免引入新的杂质;
③11.7%
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案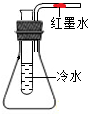 如图所示,导管内有一段红墨水,试管中盛有适量的冷水,容器的气密性良好.现往试管中加入下列某种物质,红墨水不会移动的是( )
如图所示,导管内有一段红墨水,试管中盛有适量的冷水,容器的气密性良好.现往试管中加入下列某种物质,红墨水不会移动的是( )| A. | 氢氧化钠固体 | B. | 生石灰 | C. | 浓硫酸 | D. | 蔗糖 |
| A. | 小于6毫升 | B. | 大于6毫升 | C. | 等于6毫升 | D. | 无法确定范围 |
| A. | 结构最简单的原子是氢原子 | |
| B. | 最早通过实验得出空气由N2和O2组成的结论的科学家是法国化学家汤姆生 | |
| C. | 导电性最好的金属是铜 | |
| D. | 自然界的矿物质中最硬的物质是石墨 |
| A. | 无水硫酸铜遇水变成了蓝色 | |
| B. | FeCl3溶液中滴入NaOH溶液出现蓝色沉淀 | |
| C. | 氧化铜和稀硫酸微热出现蓝色溶液 | |
| D. | 在馒头上滴加碘液,碘液变成了蓝色 |
| A. | 豆浆 | B. | 橙汁 | C. | 冰水 | D. | 啤酒 |
