题目内容
如图1为甲、乙(均不含结晶水)两种固体物质的溶解度曲线.
(1)溶解度随温度升高而增大的物质是 (填“甲”或“乙”);
(2)某同学在t1℃时开始进行如图2实验,得到相应的溶液①~③.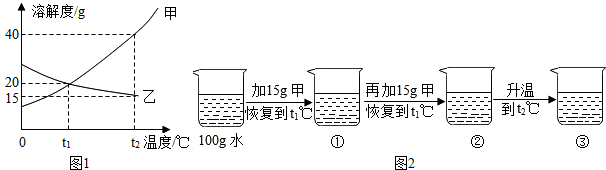
在溶液①~③中属于饱和溶液的是 (填序号),溶质质量分数最大的是 (填序号);
(3)在溶液③中再加入25g甲后,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为 (精确到0.1%).
(1)溶解度随温度升高而增大的物质是
(2)某同学在t1℃时开始进行如图2实验,得到相应的溶液①~③.

在溶液①~③中属于饱和溶液的是
(3)在溶液③中再加入25g甲后,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为
考点:固体溶解度曲线及其作用,饱和溶液和不饱和溶液,溶质的质量分数
专题:溶液、浊液与溶解度
分析:(1)根据两种物质的溶解度曲线物质甲的曲线向上,所以溶解度随温度升高而增大;
(2)t1℃时物质甲的溶解度是20 g;t2℃时物质甲的溶解度是40 g,所以30 g甲加到100 g水中得到的溶液在t1℃时是饱和溶液,但固体不能完全溶解,t2℃时30 g全部溶解,是不饱和溶液,由于③中溶质全部溶解,所得溶液中溶质的质量分数最大;
(3)t2℃时物质甲的溶解度是40 g,所以再加入25 g甲后,溶质的质量是40 g,所得溶液中溶质的质量分数为(40 g/140 g)×100%≈28.6%.
(2)t1℃时物质甲的溶解度是20 g;t2℃时物质甲的溶解度是40 g,所以30 g甲加到100 g水中得到的溶液在t1℃时是饱和溶液,但固体不能完全溶解,t2℃时30 g全部溶解,是不饱和溶液,由于③中溶质全部溶解,所得溶液中溶质的质量分数最大;
(3)t2℃时物质甲的溶解度是40 g,所以再加入25 g甲后,溶质的质量是40 g,所得溶液中溶质的质量分数为(40 g/140 g)×100%≈28.6%.
解答:解:
(1)根据两种物质的溶解度曲线物质甲的曲线向上,所以溶解度随温度升高而增大;
(2)t1℃时物质甲的溶解度是20 g;t2℃时物质甲的溶解度是40 g,所以30 g甲加到100 g水中得到的溶液在t1℃时是饱和溶液,但固体不能完全溶解,t2℃时30 g全部溶解,是不饱和溶液,由于③中溶质全部溶解,所得溶液中溶质的质量分数最大;
(3)t2℃时物质甲的溶解度是40 g,所以再加入25 g甲后,溶质的质量是40 g,所得溶液中溶质的质量分数为(40 g/140 g)×100%≈28.6%.
答案:
(1)甲;
(2)②;③;
(3)28.6%.
(1)根据两种物质的溶解度曲线物质甲的曲线向上,所以溶解度随温度升高而增大;
(2)t1℃时物质甲的溶解度是20 g;t2℃时物质甲的溶解度是40 g,所以30 g甲加到100 g水中得到的溶液在t1℃时是饱和溶液,但固体不能完全溶解,t2℃时30 g全部溶解,是不饱和溶液,由于③中溶质全部溶解,所得溶液中溶质的质量分数最大;
(3)t2℃时物质甲的溶解度是40 g,所以再加入25 g甲后,溶质的质量是40 g,所得溶液中溶质的质量分数为(40 g/140 g)×100%≈28.6%.
答案:
(1)甲;
(2)②;③;
(3)28.6%.
点评:本题以考查固体物质的溶解度曲线为主题,主要考查学生对固体物质溶解度曲线的判断和掌握能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 如图,用红磷燃烧来测定空气中氧气的含量,发生的实验现象是:
如图,用红磷燃烧来测定空气中氧气的含量,发生的实验现象是:(1)
(2)
此反应的文字表达式为
这个实验可以得出
能一次性将Na2CO3、Ba(OH)2、稀HCl三种无色溶液鉴别出来的试剂是( )
| A、紫色石蕊 |
| B、AgNO3溶液 |
| C、BaCl2溶液 |
| D、稀H2SO4 |
甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是( )


| A、甲物质的溶解度为20g |
| B、t1℃时,30g甲加入到50g水中最多可得60g溶液 |
| C、t2℃时,乙物质的饱和溶液升温变成不饱和溶液 |
| D、t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:乙<甲 |
有一瓶气体可能由H2,CH4,C2H6的一种或几种组成.实验测定发现该气体含碳氢两种元素,且原子个数比是C:H=1:5,有如下几种可能组成,经分析判断不可能是( )
| A、CH4、C2H6 |
| B、H2、CH4 |
| C、H2、C2H6 |
| D、H2、CH4、C2H6 |
 如图,A、B、C为三种物质的溶解度曲线,请根据图示信息回答下列问题.
如图,A、B、C为三种物质的溶解度曲线,请根据图示信息回答下列问题. 如图是甲、乙两种固体物质的溶解度曲线.回答下列问题:
如图是甲、乙两种固体物质的溶解度曲线.回答下列问题: