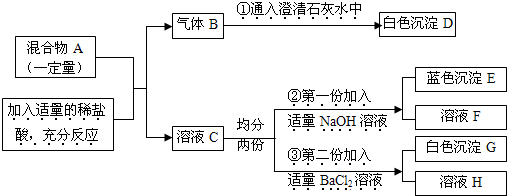
题目内容
29、固体A中可能含有Na2SO4、CuSO4、Na2CO3、NaCl、NaNO3中的一种或几种,进行如下实验,观察、记录现象如表:
你的结论是:A中一定没有
步骤②反应的化学方程式为
步骤③反应的化学方程式为
| 实验步骤及现象 |
| ①取少许固体A放到烧杯中,加适量水溶解,得到无色溶液B. |
| ②取少量B溶液于试管中,滴加足量稀盐酸时,有气泡产生.反应结束后得到溶液C. |
| ③取少量C溶液于试管中,加入足量BaCl2溶液,生成白色沉淀. |
| ④取少量C溶液于试管中,加入足量AgNO3溶液,生成白色沉淀. |
CuSO4
;A中一定有Na2CO3、Na2SO4
,A中可能有NaCl、NaNO3
;步骤②反应的化学方程式为
Na2CO3+2HCl=2NaCl+CO2↑+H2O
;步骤③反应的化学方程式为
Na2SO4+BaCl2=BaSO4↓+2NaCl
.分析:根据固体A可能含有物质及实验中的现象,对固体A中一定含、一定没有与可能含有的物质进行判断;判断时需要注意以下几点:一是含硫酸铜的溶液呈蓝色,溶液呈无色则一定不含硫酸铜;二是滴加足量稀盐酸有气体产生,一定含有碳酸盐,且碳酸盐被完全反应,为下一步滴加氯化钡产生沉淀排除碳酸盐的影响;三滴加氯化钡产生白色沉淀可判断溶液C中含硫酸根,滴加硝酸银产生白色沉淀可判断溶液C中含氯离子.
解答:解:根据固体A溶于水得到无色溶液,可以确定固体A中一定不含CuSO4;根据向溶解所得无色溶液B中滴加足量的稀盐酸时产生气体,可以确定在固体A中一定含有Na2CO3,并且Na2CO3被完全反应,反应后所得溶液C中不含碳酸根;向少量溶液C中加足量的BaCl2溶液且产生白色沉淀,可以判断固体A中一定含有Na2SO4;而向少量溶液C中滴加AgNO3溶液时有白色沉淀,该白色沉淀却不能证明固体A中含有NaCl,原因是溶液C是碳酸钠与盐酸反应后的溶液,即使固体A中不含NaCl反应后溶液C中也会含有NaCl;因此,固体A的可能含有的物质中,NaCl、NaNO3不能确定是否含有;
综上所述,固体A中一定不含有CuSO4;一定含有Na2CO3、Na2SO4;可能含有NaCl、NaNO3;
故答案为:CuSO4;Na2CO3、Na2SO4;NaCl、NaNO3;
步骤②滴加的足量稀盐酸与溶液B中的碳酸钠充分反应,生成氯化钠、水和二氧化碳气体;
故答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
步骤③取少量C溶液滴加BaCl2溶液时,与溶液中的Na2SO4发生复分解反应,通过交换机成分生成BaSO4沉淀和NaCl;
故答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl.
综上所述,固体A中一定不含有CuSO4;一定含有Na2CO3、Na2SO4;可能含有NaCl、NaNO3;
故答案为:CuSO4;Na2CO3、Na2SO4;NaCl、NaNO3;
步骤②滴加的足量稀盐酸与溶液B中的碳酸钠充分反应,生成氯化钠、水和二氧化碳气体;
故答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
步骤③取少量C溶液滴加BaCl2溶液时,与溶液中的Na2SO4发生复分解反应,通过交换机成分生成BaSO4沉淀和NaCl;
故答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl.
点评:根据所提供的可能存在的物质的性质,结合实验现象逐渐确定或排除物质,是解决此类实验推断题的最基本方法.

练习册系列答案
 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目