题目内容
19.下列说法正确的是( )| A. | 氧化反应一定是化合反应 | |
| B. | 没有颜色和气味的气体一定是空气 | |
| C. | 工业上常用分离液态空气获得氮气和氧气,该过程属于分解反应 | |
| D. | 铁生锈、面粉发酵均属于缓慢氧化 |
分析 A、依据氧化反应的概念分析解答;
B、没有颜色和气味的气体不一定是空气,例如氧气、氮气等物质都是无色无味的气体;
C、根据液态空气中分离氮气和氧气,是利用了液态氮和液态氧沸点的不同解答;
D、铁生锈、面粉发酵均属于缓慢氧化.
解答 解:A、氧化反应是物质与氧的反应,与化合反应“多变一”的特点无关,故错误;
B、没有颜色和气味的气体不一定是空气,例如氧气、氮气等物质都是无色无味的气体,错误;
C、从液态空气中分离氮气和氧气,是利用了液态氮和液态氧沸点的不同,属于物理变化,错误;
D、铁生锈、面粉发酵均属于缓慢氧化,正确.
故选D.
点评 难度不大,熟练掌握有关知识,可以正确解答.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
1.据报道,科学家使用的普通氧分子与带电的氧离子作用,制造出新物质O4,下列关于O4的说法中,正确的是( )
| A. | O4中氧元素的化合价为-2 | B. | O4分子是由氧元素构成的 | ||
| C. | O4与O2、O3都是氧单质 | D. | 合成O4的反应属于物理变化 |
7. 某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况(反应后金属的化合价均是正2价),进行了如下实验:取等质量颗粒大小相同的X、Y、Z分别与足量的溶质质量分数相同的稀硫酸反应,反应情况用图来表示,下列对该图象理解的叙述中,正确的是( )
某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况(反应后金属的化合价均是正2价),进行了如下实验:取等质量颗粒大小相同的X、Y、Z分别与足量的溶质质量分数相同的稀硫酸反应,反应情况用图来表示,下列对该图象理解的叙述中,正确的是( )
 某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况(反应后金属的化合价均是正2价),进行了如下实验:取等质量颗粒大小相同的X、Y、Z分别与足量的溶质质量分数相同的稀硫酸反应,反应情况用图来表示,下列对该图象理解的叙述中,正确的是( )
某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况(反应后金属的化合价均是正2价),进行了如下实验:取等质量颗粒大小相同的X、Y、Z分别与足量的溶质质量分数相同的稀硫酸反应,反应情况用图来表示,下列对该图象理解的叙述中,正确的是( )| A. | 相对原子质量的大小:Z>Y>X | B. | 金属Z反应最慢 | ||
| C. | X、Y、Z依次可能是Mg、Fe、Zn | D. | 金属活动性由强到弱:X、Y、Z |
14.下列物质的应用是由化学性质决定的是( )
| A. | 石墨用于制铅笔芯 | B. | 金属铜丝作导线 | ||
| C. | 氦气用作焊接金属保护气 | D. | 金刚石作钻探机的钻头 |
11.下列有关碳及其氧化物的说法错误的是( )
| A. | CO与CO2 可用石蕊试液区分 | |
| B. | CO具有还原性,可用于冶炼金属 | |
| C. | 二氧化碳浓度过大会致人死亡,是因为二氧化碳有毒 | |
| D. | 金刚石和石墨结构中碳原子排列方式不同 |
9.某化工厂用石灰石和废铜屑等设计生产石青、波尔多液的工艺流程如下:
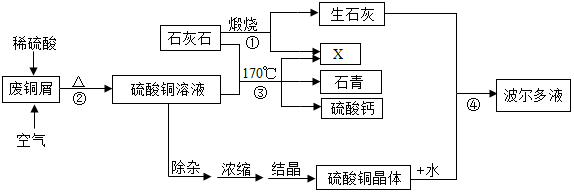
一、产品制备
(1)流程图中X的化学式为CO2;
(2)反应②的总化学方程式为2H2SO4+2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
(3)硫酸铜晶体(CuSO4•5H2O)的溶解度如下表:
蒸发浓缩后热溶液经处理大量析出晶体,温度到达30℃时,剩余硫酸铜溶液的溶质质量分数为20%;待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,用冰水洗涤的目的是:
Ⅰ是除去晶体表面的杂质;Ⅱ是0℃时,硫酸铜溶解度较小,损失少.
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其化学方程式为:
Ⅰ是CaO+H2O═Ca(OH)2;Ⅱ是Ca(OH)2+CuSO4═CaSO4+Cu(OH)2↓.
二、组成测定
查阅资料得知,石青的化学式可表示为aCuCO3•bCu(OH)2,已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃.为测定其组成,小组同学称取石青样品34.6g,用如图装置进行实验.
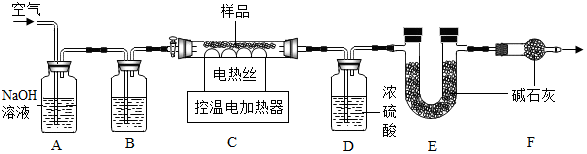
(5)洗气瓶A中氢氧化钠溶液的作用是除去空气中的二氧化碳;B中所装液体为浓硫酸.
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g.通过计算可得:a:b=2:1..
(7)若缺少F装置,测得的a:b偏大(选填“偏大”、“偏小”、“不变”).
三、脱水探究
硫酸铜晶体受热会逐步失去结晶水.取纯净CuSO4•5H2O固体2.50g,放在如图实验装置C中进行加热,测定固体质量随温度的变化情况如图所示.
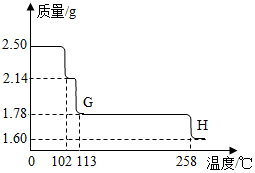
(8)G点固体的化学式是CuSO4•H2O.
(9)G→H看到的现象是白色.
(10)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑+5H2O↑.

一、产品制备
(1)流程图中X的化学式为CO2;
(2)反应②的总化学方程式为2H2SO4+2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
(3)硫酸铜晶体(CuSO4•5H2O)的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
Ⅰ是除去晶体表面的杂质;Ⅱ是0℃时,硫酸铜溶解度较小,损失少.
(4)反应④中硫酸铜、生石灰和水制备波尔多液,其化学方程式为:
Ⅰ是CaO+H2O═Ca(OH)2;Ⅱ是Ca(OH)2+CuSO4═CaSO4+Cu(OH)2↓.
二、组成测定
查阅资料得知,石青的化学式可表示为aCuCO3•bCu(OH)2,已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃.为测定其组成,小组同学称取石青样品34.6g,用如图装置进行实验.

(5)洗气瓶A中氢氧化钠溶液的作用是除去空气中的二氧化碳;B中所装液体为浓硫酸.
(6)现控制C装置中的温度为250℃对石青进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气后,冷却后装置D增重1.8g,装置E增重8.8g.通过计算可得:a:b=2:1..
(7)若缺少F装置,测得的a:b偏大(选填“偏大”、“偏小”、“不变”).
三、脱水探究
硫酸铜晶体受热会逐步失去结晶水.取纯净CuSO4•5H2O固体2.50g,放在如图实验装置C中进行加热,测定固体质量随温度的变化情况如图所示.

(8)G点固体的化学式是CuSO4•H2O.
(9)G→H看到的现象是白色.
(10)将CuSO4•5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的一种氧化物和水蒸气,该反应的化学方程式为:CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑+5H2O↑.

