题目内容
课外活动小组的同学在测定由NaCl 和Na2CO3形成的固体混合物组成时,进行了以下实验:取40克固体混合物配成溶液,平均分为4份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
|
|
实验一 |
实验二 |
实验三 |
实验四 |
|
原固体混合物的质量 |
10g |
10g |
10g |
10g |
|
加入CaCl2溶液质量 |
10g |
20g |
30g |
40g |
|
生成的沉淀的质量 |
2g |
m |
5g |
5g |
请分析表中的数据回答并计算:
〔1〕 生成的沉淀是〔填写化学式〕
〔2〕 10g原固体混合物配成的溶液和足量CaCl2溶液反应,最多生成沉淀质量为
g
〔3〕 m = g
〔4〕 原固体混合物中Na2CO3的质量分数是多少?
【答案】
(1)CaCO3 (2)5g (3)m=4g (4)53%
【解析】(1)氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠
(2)生成最多的沉淀的质量,应是完全反应后生成的沉淀质量,所以最多生成沉淀质量可由分析图表得到;
(3)根据实验数据,加入10gCaCl2溶液完全反应可生成沉淀质量为2g,加入30gCaCl2溶液时仍有沉淀生成,可判断表中m的值;
(4)加入氯化钙溶液至完全反应时,生成沉淀质量为5g,根据碳酸钠与氯化钙反应的化学方程式,可由生成沉淀碳酸钙的质量计算中原固体混合物中Na2CO3的质量,即可求得原固体混合物中Na2CO3的质量分数.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
课外活动小组的同学在测定由NaCl和Na2CO3形成的固体混合物组成时,进行了以下实验:取40g固体混合物配成溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
请分析表中数据回答并计算.
(1)m= g.
(2)原固体混合物中Na2CO3的质量分数是多少? .
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 原固体混合物质量 | 10g | 10g | 10g | 10g |
| 加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的质量 | 2g | m | 5g | 5g |
(1)m=
(2)原固体混合物中Na2CO3的质量分数是多少?
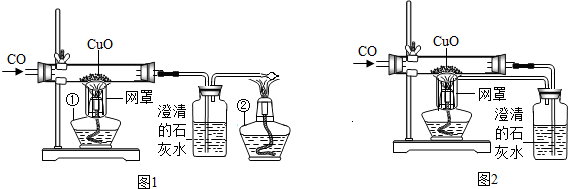
 某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分Fe2O3)炼铁的主要反应原理.他们设计的实验装置,如图:
某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分Fe2O3)炼铁的主要反应原理.他们设计的实验装置,如图: