题目内容
15.生活中常见物质的性质、制法的是化学研究的重要内容.(1)复分解反应发生后,生成物肯定不会是单质(填“单质”或“化合物”).
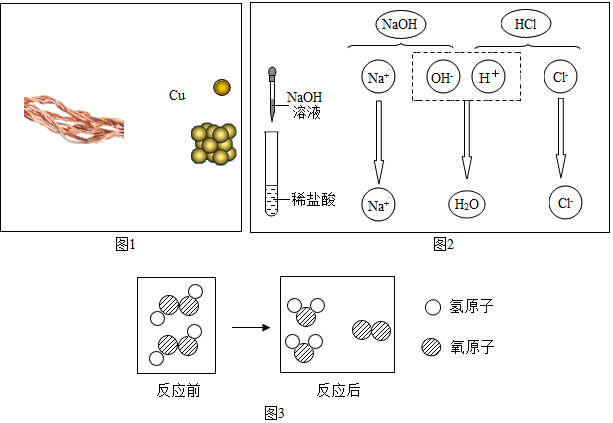
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图1所示.下列说法正确的c.
a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液呈红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
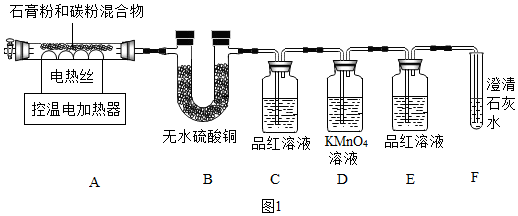
(3)如图2装置可作一氧化碳还原氧化铁的实验,并检验生成的气体产物.

①B装置玻璃管里可观察到的现象为红色固体变黑.
②C装置中反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O.
③工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将这些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?
分析 (1)根据在复分解反应中,反应物和生成物都是两种化合物,没有单质生成进行分析;
(2)根据图象这pH值得变化趋势和化学反应的原理进行分析;
(3)①根据氧化铁和一氧化碳在高温的条件下生成铁和二氧化碳进行分析;
②根据二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水进行分析;
③根据化学方程式和题中的数据进行计算.
解答 解:(1)在复分解反应中,反应物和生成物都是两种化合物,没有单质生成;
(2)a、m点所示溶液的pH值小于7,所以溶液为酸性,故错误;
b、n点所示溶液的pH值等于7,所以溶液中加紫色石蕊溶液,颜色不变,故错误;
c、p点所示溶液的pH值大于7,所以溶液中的溶质为NaCl和NaOH,故正确;
d、该图中pH值是从小于7逐渐的增大到7,然后大于7,所以所对应操作是将氢氧化钠滴入盐酸中,故错误;
故选:c;
(3)①氧化铁和一氧化碳在高温的条件下生成铁和二氧化碳,所以B装置玻璃管里可观察到的现象为:红色固体变黑;
②二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
③设需要消耗铝的质量为x,
8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3
216 504
x 25.2g
$\frac{216}{x}$=$\frac{504}{25.2g}$
x=10.8kg
故答案为:(1)单质;(2)c;(3)①红色固体变黑;②CO2+Ca(OH)2=CaCO3↓+H2O;③理论上需要消耗铝的质量是10.8kg.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的提示进行解答.

练习册系列答案
相关题目
5.某学生为了验证锌、银、铜三种金属的活动性顺序,设计了五个实验:①将Zn、Cu分别放入稀盐酸中;②将Ag放入Cu(NO3)2溶液中;③将Cu放入AgNO3溶液中;④将Cu放入ZnSO4溶液中;⑤将Zn放入AgNO3溶液中.下列实验组合不能验证锌、银、铜三种金属活动性顺序的是( )
| A. | ①② | B. | ①③ | C. | ②④ | D. | ①⑤ |
6.下列排序正确的是( )
| A. | 地壳中的元素含量: | B. | 硫元素的化合价: | ||
| C. | 物质的溶解性: | D. | 铁元素的质量分数: |
3.下列物质的名称、俗名与化学式完全对应的是( )
| A. | 氢氧化钙 熟石灰 CaO | B. | 乙醇 酒精 CH3COOH | ||
| C. | 氢氧化钠 纯碱 NaOH | D. | 碳酸氢钠 小苏打 NaHCO3 |
10.下列说法错误的是( )
| A. | 用洗涤剂去油污属于乳化 | |
| B. | 配制一定质量分数的溶液一定要用到托盘天平 | |
| C. | KNO3中混有少量NaCl,常用降温结晶的方法提纯KNO3 | |
| D. | 铵态氮肥不能和碱性物质混合施用,否则会产生氨气,降低肥效 |
4.下列选项中物质的俗名、化学式、类别、用途完全对应的是( )
| A. | 纯碱 Na2CO3 碱 制玻璃 | |
| B. | 生石灰 CaO 氧化物 补钙剂 | |
| C. | 食盐 NaCl 盐 除铁锈 | |
| D. | 火碱 NaOH 碱 生成洗涤剂 |