题目内容
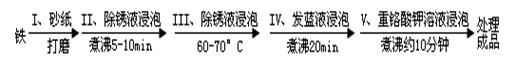
钢铁易腐蚀.工业生产中常对钢铁零件“发蓝”处理,以避免(减缓)腐蚀.所谓“发蓝”,就是将钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜.“发蓝”处理过程可表示如下:
铁
处理成品
(1)经“发蓝”处理后的钢铁零件表面上的蓝黑色氧化膜能够避免(减缓)钢铁腐蚀的原因是
(2)步骤II用除锈液(15%的硫酸溶液)浸泡铁的目的在于除去铁表面的铁锈.处理时,浸泡时间不宜过长,否则铁将被溶解(化学方程式为
(3)为检验步骤Ⅳ处理的铁表面是否形成致密的氧化膜,常往其表面滴5%硫酸铜溶液一段时间.如果氧化膜不致密(铁部分裸露出来),将观察到
(4)除锈后的铁片在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应,其中之一为8Fe+3NaNO3+5NaOH+2H2O═4Na2Fe2O4+3X↑.则上述反应中X所代表物质对应的化学式为
铁
| 1.砂纸 |
| 打磨 |
| 2.除锈液浸泡 |
| 煮沸5-10min |
| 3.除锈液浸泡 |
| 60-70℃ |
| 4.发蓝液浸泡 |
| 煮沸20min |
| 5.重铬酸钾溶液浸泡 |
| 煮沸约10分钟 |
(1)经“发蓝”处理后的钢铁零件表面上的蓝黑色氧化膜能够避免(减缓)钢铁腐蚀的原因是
致密的氧化膜覆盖在钢铁表面,使钢铁零件与外界的空气、水分等隔绝
致密的氧化膜覆盖在钢铁表面,使钢铁零件与外界的空气、水分等隔绝
.(2)步骤II用除锈液(15%的硫酸溶液)浸泡铁的目的在于除去铁表面的铁锈.处理时,浸泡时间不宜过长,否则铁将被溶解(化学方程式为
Fe+H2SO4═FeSO4+H2↑
Fe+H2SO4═FeSO4+H2↑
).(3)为检验步骤Ⅳ处理的铁表面是否形成致密的氧化膜,常往其表面滴5%硫酸铜溶液一段时间.如果氧化膜不致密(铁部分裸露出来),将观察到
在铁的表面有红色的物质出现
在铁的表面有红色的物质出现
.(4)除锈后的铁片在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应,其中之一为8Fe+3NaNO3+5NaOH+2H2O═4Na2Fe2O4+3X↑.则上述反应中X所代表物质对应的化学式为
NH3
NH3
.分析:(1)根据铁生锈的条件分析;
(2)根据铁与硫酸的反应,写出反应的方程式;
(3)根据铁与硫酸铜的反应分析实验的现象;
(4)根据质量守恒定律反应前后原子的种类及数目不变分析X的化学式.
(2)根据铁与硫酸的反应,写出反应的方程式;
(3)根据铁与硫酸铜的反应分析实验的现象;
(4)根据质量守恒定律反应前后原子的种类及数目不变分析X的化学式.
解答:解:(1)铁生锈的条件是铁与氧气和水同时接触,由于致密的氧化膜覆盖在钢铁表面,使钢铁零件与外界的空气、水分等隔绝.所以,经“发蓝”处理后的钢铁零件表面上的蓝黑色氧化膜能够避免(减缓)钢铁腐蚀.
(2)由于铁能与硫酸反应,所以,在用硫酸处理铁表面的铁锈时,浸泡时间不宜过长,否则铁将被溶解.反应的化学方程式为:Fe+H2SO4═FeSO4+H2↑.
(3)如果氧化膜不致密,裸露出来的铁与硫酸铜的反应生成了铜和氯化亚铁.所以实验现象是:在铁的表面有红色的物质出现;
(4)在方程式8Fe+3NaNO3+5NaOH+2H2O═4Na2Fe2O4+3X↑中,左边有铁、钠、氮、氧、氢原子的个数分别是:8、8、3、16、9,在右边有铁、钠、氧原子的个数分别是:8、8、16.根据质量守恒定律反应前后原子的种类及数目不变可知,X的化学式为NH3.
故答为:(1)致密的氧化膜覆盖在钢铁表面,使钢铁零件与外界的空气、水分等隔绝;(2)Fe+H2SO4═FeSO4+H2↑;(3)在铁的表面有红色的物质出现;(4)NH3.
(2)由于铁能与硫酸反应,所以,在用硫酸处理铁表面的铁锈时,浸泡时间不宜过长,否则铁将被溶解.反应的化学方程式为:Fe+H2SO4═FeSO4+H2↑.
(3)如果氧化膜不致密,裸露出来的铁与硫酸铜的反应生成了铜和氯化亚铁.所以实验现象是:在铁的表面有红色的物质出现;
(4)在方程式8Fe+3NaNO3+5NaOH+2H2O═4Na2Fe2O4+3X↑中,左边有铁、钠、氮、氧、氢原子的个数分别是:8、8、3、16、9,在右边有铁、钠、氧原子的个数分别是:8、8、16.根据质量守恒定律反应前后原子的种类及数目不变可知,X的化学式为NH3.
故答为:(1)致密的氧化膜覆盖在钢铁表面,使钢铁零件与外界的空气、水分等隔绝;(2)Fe+H2SO4═FeSO4+H2↑;(3)在铁的表面有红色的物质出现;(4)NH3.
点评:本题主要考查了铁与酸、盐反应的性质、铁生锈的条件等知识,金属的知识是重要的内容,应加强学习.

练习册系列答案
相关题目

 人类的生产生活离不开金属,下列三种金属被发现、使用的先后顺序依次为:铜、铁、铝.
人类的生产生活离不开金属,下列三种金属被发现、使用的先后顺序依次为:铜、铁、铝.