题目内容
某碳酸钠样品中含有少量氯化钠杂质。现将一定量样品放入烧杯中,称得总质量为163.9g,加入146.1g氯化钙溶液,恰好完全反应,产生沉淀10g,过滤后,所得溶液中溶质的质量分数为10%,计算样品中Na2CO3的质量分数?
(反应方程式为:Na2CO3 +CaCl2 === 2NaCl + CaCO3↓)
【答案】

 ---------------1分
---------------1分
解:设样品中NaCl的质量为m,样品中Na2CO3的质量为x,生成的
NaCl的质量为y
Na2CO3 + CaCl2 = 2NaCl + CaCO3↓
106 117 100
x y 10g
|

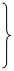 |
|
 ---------------1分
---------------1分
10.6g + m + 146.1g – 10g = (11.7g +m) ÷ 10%
m= 3.3g ---------------1分
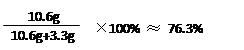 ---------------1分
---------------1分
答:样品中Na2CO3的质量分数为76.3%。
【解析】已知产生的10克沉淀就是碳酸钙,据此根据化学反应方程式即可计算了具体步骤见答案。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
为验证并除去食盐晶体中含有少量的Na2CO3和Na2SO4两种杂质,现设计了如下实验方案:

请回答:
(1)食盐晶体中加入A溶液是______;操作1是利用______方法进行混合物分离.
(2)溶液乙中含有的溶质是______.沉淀2是______物质.
(3)利用此实验方案所得的NaCl晶体质量比样品中NaCl晶体质量______.(填“多”或“少”)
(4)为了测定50克的氢氧化钠和碳酸钠混合溶液中氢氧化钠的含量,某实验探究小组利用中和反应的原理进行实验,实验步骤如下:
步骤(一):除去混合液中的碳酸钠
| 实验步骤 | 实验现象 |
| 在混合液中加入过量的氯化钙溶液,充分反应后过滤,得到澄清溶液 | 产生白色沉淀 |
| 所得滤液中的溶质是:______填化学式) | |
 水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.
水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化. ?
? 水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.
水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.