题目内容
相同质量,质量分数的盐酸和氢氧化钠溶液反应后,溶液的pH
[ ]
A.大于7
B.等于7
C.小于7
D.无法确定
答案:C
解析:
解析:
|
通过 40 36.5 反应后的溶液显酸性。 |

练习册系列答案
相关题目
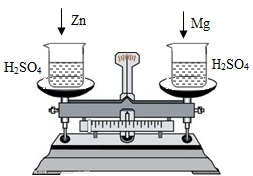 在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相同质量分数的稀硫酸,然后按下图所示分别投入相同质量的锌和镁带,待反应停止后,天平指针的可能指向是( )
在托盘天平两边各放一只烧杯,调节至平衡,再向两只烧杯中各注入相同质量相同质量分数的稀硫酸,然后按下图所示分别投入相同质量的锌和镁带,待反应停止后,天平指针的可能指向是( )①分度盘的左边 ②分度盘的中间 ③分度盘的右边.
| A、仅① | B、仅② | C、①② | D、②③ |
NaNO2是-种致癌物质.某兴趣小组为研究水中NaNO2的含量和消除污染的方法,进行了如下目视比色法实验(比较溶液颜色深浅以测定物质浓度的方法),请你参与实验,并填空:
(1)测定方法的研究
配制质量分数为0.07%的NaNO2标准溶液,分别取0、2、4、6、8、10 mL标准溶液于6支试管,加蒸馏水至总体积均为l0mL,分别加入约0.30gM粉未(M是氨基苯磺酸),振荡后制成颜色深浅不同的标准色阶.测定时取10 mL水样,加入约0.30gM粉末,振荡后与标准色阶比较,得出颜色相同的色阶所含标准溶液的毫升数,再按稀释比例计算出水样中NaNO2的质量分数.
①配制质量分数为0.07%的NaNO2溶液l000 mL,所需NaNO2的质量是______g;
②用上述方法测定某水样,其与含2 mL标准溶液的色阶颜色相同,此水样中NaNO2的质量分数为______;
(2)研究某水样在不同煮沸时间后NaNO2含量的变化将另一水样用右图装置煮沸,测定不同煮沸时间NaNO2的质量分数,结果为:
①兴趣小组设计的右图实验装置用到了蒸气回流装置,其作用是______;
②根据上述数据,可见此水样随煮沸时问的延长NaNO2的质量分数会逐渐______;
(3)寻找能降低水中NaNO2含量的物质,研究消除污染的有效方法
查阅资料可知,加入醋酸或双氧水可降低水中NaNO2的质量分数,请设计实验证明少量醋酸是否有降低水中NaNO2质量分数的作用,填写下列实验报告:

(1)测定方法的研究
配制质量分数为0.07%的NaNO2标准溶液,分别取0、2、4、6、8、10 mL标准溶液于6支试管,加蒸馏水至总体积均为l0mL,分别加入约0.30gM粉未(M是氨基苯磺酸),振荡后制成颜色深浅不同的标准色阶.测定时取10 mL水样,加入约0.30gM粉末,振荡后与标准色阶比较,得出颜色相同的色阶所含标准溶液的毫升数,再按稀释比例计算出水样中NaNO2的质量分数.
①配制质量分数为0.07%的NaNO2溶液l000 mL,所需NaNO2的质量是______g;
②用上述方法测定某水样,其与含2 mL标准溶液的色阶颜色相同,此水样中NaNO2的质量分数为______;
(2)研究某水样在不同煮沸时间后NaNO2含量的变化将另一水样用右图装置煮沸,测定不同煮沸时间NaNO2的质量分数,结果为:
| 煮沸时间(小时) | 2 | 4 | 8 | 12 | |
| NaNO2的质量分数 | 0.014% | 0.028% | 0.056% |
②根据上述数据,可见此水样随煮沸时问的延长NaNO2的质量分数会逐渐______;
(3)寻找能降低水中NaNO2含量的物质,研究消除污染的有效方法
查阅资料可知,加入醋酸或双氧水可降低水中NaNO2的质量分数,请设计实验证明少量醋酸是否有降低水中NaNO2质量分数的作用,填写下列实验报告:
| 实验步骤 | 可能的实验现象 | 根据可能的实验现象得出的结论 |

 小孙买了一种“汽泡爽”的冲调饮料.
小孙买了一种“汽泡爽”的冲调饮料.