��Ŀ����
��嫵Ĵ����̲��ŷḻ����Դ��������ˮ��Դǰ��������̽��ѧϰС���Ժ���Ca2+��Mg2+��Cl�����ӵ�±ˮ�ͱ��ǣ���Ҫ�ɷ�ΪCaCO3��Ϊ��Ҫԭ����ʵ�����Ʊ���ˮCaCl2��������ͼ��ʾ��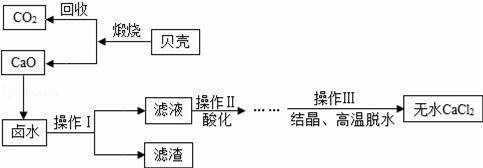

��ش��������⣺
��1���������е������ǣ��ò����в�������������������
��2����MgCl2Ϊ����д��±ˮ�г�ȥMg2+ʱ������Ӧ�Ļ�ѧ����ʽ������
��3���������ữʱӦѡ��������������ϡ���ᡱ��ϡ���ᡱ����
��4����ˮ����Ȼ��ġ��ο⡱�����dzԵ�ʳ�δ����Ժ�ˮɹ�Σ���ˮɹ�ε���Ҫԭ����������
�����㡿�Ժ�����Դ�ĺ������������ã����˵�ԭ������������Ӧ�ã��εĻ�ѧ���ʣ���ˮɹ�ε�ԭ�����̣�
��ר�⡿���ʵ��Ʊ���
����������1�����ݷ�������ķ����Լ���������;��������
��2�������Ȼ�þת��Ϊ������þ�ķ�Ӧ��д����Ӧ�Ļ�ѧ����ʽ��
��3�����ݸù�������ȡCaCl2�����е���ֻ�������
��4�������Ȼ��Ƶ��ܽ�����¶ȵ�Ӱ����������
����𡿽⣺��1���������Ƿ��������Һ��ķ������ǹ��ˣ��ڹ��˲����У���������������������������ˣ�������
��2���ɷ�Ӧ�����̿�֪����ȥMg2+ʱ�����������ƣ��Ȼ�þת��Ϊ������þ�ķ�Ӧ���Ȼ�þ���������Ʒ�Ӧ������������þ�������Ȼ��ƣ���Ӧ�Ļ�ѧ����ʽ�ǣ�MgCl2+Ca��OH��2=CaCl2+Mg��OH��2�������MgCl2+Ca��OH��2=CaCl2+Mg��OH��2����
��3���ù�������ȡCaCl2�����е���ֻ����������ϡ���
��4���Ȼ��Ƶ��ܽ�����¶�Ӱ��Ƚ�С�����Ժ�ˮɹ�ε�ԭ���������ᾧ����������ᾧ��
��������������Ҫ����ʵ�����������֮������á���ѧ����ʽ����д�ȷ����֪ʶ����д��ѧ����ʽҪע��淶�ԣ�
��










