题目内容
欲测定某石灰石样品中碳酸钙的质量分数,甲、乙两位同学分别设计了如下两个实验方案:(已知碳酸钙在900℃左右可分解生成氧化钙和二氧化碳,化学方程式为:CaCO3
 CaO+CO2↑;石灰石样品中的杂质受热不分解,且不与酸反应)
CaO+CO2↑;石灰石样品中的杂质受热不分解,且不与酸反应)
方案一:①称取石灰石样品质量8g;②用酒精灯加热样品,直至质量不再改变;③将固体残余物放在干燥的器皿中冷却后称得质量6.9g;④计算.
方案二:①称取石灰石样品质量8g;②加入质量分数为7.3%的盐酸100g,使碳酸钙完全反应;③向反应后的溶液中加入含溶质3.2g的氢氧化钠溶液,恰好中和多余的盐酸;④计算.
请回答下列有关问题:
(1)经过讨论,他们认为上述方案中,切实可行的是方案二.不选用方案一的原因是: .
(2)求方案二样品中碳酸钙的质量分数.
【考点】根据化学反应方程式的计算.
【专题】有关化学方程式的计算;有关溶液溶质质量分数的计算.
【分析】(1)根据碳酸钙的性质进行分析.在第一个方案中用酒精灯加热,温度达不到石灰石分解的高温要求;方案二中碳酸钙可以和盐酸发生反应.
(2)先求与氢氧化钠反应的HCl质量,再求与碳酸钙反应的稀盐酸质量,计算碳酸钙的质量分数.
【解答】解:(1)由题意可知,第一个方案中用酒精灯加热,温度达不到石灰石分解的高温要求,方案二中碳酸钙可以和盐酸发生反应.所以,上述方案中可行的是方案二.
故答案是:用酒精灯加热,温度达不到石灰石分解的高温要求.
(2)解:设与氢氧化钠反应的HCl质量为x.
HCl+NaOH=NaCl+H2O
36.5 40
x 3.2g
则
 ,解得x=2.92g.
,解得x=2.92g.
则与碳酸钙反应的稀盐酸为100g×7.3%﹣2.92g=4.38g.
设与4.38gHCl反应的碳酸钙的质量为y.
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73
y 4.38g
则
 ,解得y=6g.
,解得y=6g.
故样品中碳酸钙的质量分数为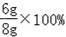
 =75%.
=75%.
故答案为:
(1)用酒精灯难以让碳酸钙完全分解.(2)75%.
【点评】本题主要考查了碳酸钙的性质及化学方程式的计算,会根据碳酸钙的性质分析判断方案的可行性.

 单元期中期末卷系列答案
单元期中期末卷系列答案

 2Al2O3 这一反应中,Al、O2、Al2O3三种物质之间的质量比为( )
2Al2O3 这一反应中,Al、O2、Al2O3三种物质之间的质量比为( )