��Ŀ����
����Ŀ����ѧ��ȤС�������ȡ������ʵ���о������dz�ȡ5.5g����غ�5.0g������ػ����һ����ּ��ȣ���Ӧ�õ���ͼ��ʾ��ͼ���Իش�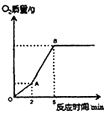
��1��ͼ����OA�β�����������Ҫ���� ���ѧʽ���ֽ�õ���AB�β����������������Ա�OA�ο죬��������ٶȼӿ��ԭ��
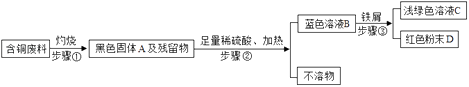
��2����Ӧ������ʣ������ˮ����ܽ⣨��ʾ����MnO2�⣬�������嶼����ˮ����Ȼ����ˡ�ϴ�ӡ���ɡ�����������MnO2���壮����ɹ��˲���ʱ���õ��IJ��������У��ձ����������� �� ����ʱ����������������
��3���÷�Ӧ�Мh������ʵ������ȡ�������������ű���ʽ�ֱ��ǣ��� ��
���𰸡�
��1��KMnO4��OA�ηֽ������MnO2 �� �ӿ���KClO3�ķֽ�����
��2��©��������
��3��2KMnO4 ![]() K2MnO4+MnO2+O2����2KClO3
K2MnO4+MnO2+O2����2KClO3  2KCl+3O2��
2KCl+3O2��
���������⣺��1����������ڽϵ͵��¶��¾��ֽܷ��������������������Ҫ���¶Ƚϸߣ������ڸ�����طֽ���敏���������̵Ĵ�������Ҳ�ܿ��ٷֽ��������������KMnO4��OA�ηֽ������MnO2 �� �ӿ���KClO3�ķֽ����ʣ�
��2.�������õ��IJ��������У��ձ�����������©���������������������������©����������
��3.���⣺����ʵ������ȡ�����ķ�Ӧԭ����ֱ�Ӽ��ȸ�����ؿ���ȡ��������˽�����غ�����صĻ���������ȡ�������ȷ�Ӧ������������ ������أ���Ӧ�Ļ�ѧ����ʽΪ��2KMnO4 ![]() K2MnO4+MnO2+O2����
K2MnO4+MnO2+O2����
�ж������̲���������ؿ�ʼ��Ӧ��ȡ��������Ӧ�Ļ�ѧ����ʽΪ��2KClO3  2KCl+3O2����
2KCl+3O2����
�𰸣���1��KMnO4��OA�ηֽ������MnO2 �� �ӿ���KClO3�ķֽ����ʣ���2��©������������3��2KMnO4 ![]() K2MnO4+MnO2+O2����2KClO3
K2MnO4+MnO2+O2����2KClO3  2KCl+3O2����
2KCl+3O2����
�����㾫�������ù��˲�����ע���������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪���˲���ע�������һ���������͡������������˺���Һ��Ȼ���ǵĿ���ԭ����:�ٳн���Һ���ձ����ɾ����㵹Һ��ʱҺ�������ֽ��Ե����ֽ����ע�⣺a����ƽ b������ c�����ţ�