题目内容
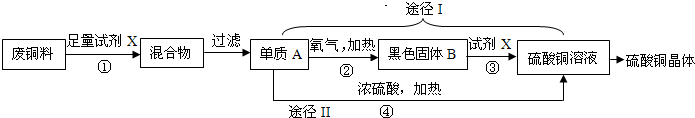
硫酸铜晶体常用作农业和渔业的杀虫剂、杀菌剂.以下是由废铜料(含铁)生产硫酸铜晶体的流程.

(1)反应①的化学方程式为________.
(2)途径Ⅰ中,反应②、③的化学方程式分别为②________,③________;途径Ⅱ中,反应④的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O.从环保和经济的角度分析,利用途径________(选填“Ⅰ”或“Ⅱ”)制取硫酸铜的方案更合理.
CuSO4+SO2↑+2H2O.从环保和经济的角度分析,利用途径________(选填“Ⅰ”或“Ⅱ”)制取硫酸铜的方案更合理.
(3)某化学兴趣小组同学用足量铜与10 g质量分数为98%的浓硫酸在加热条件下充分反应,生成SO2的质量应________(选填字母).
A.等于3.2 g
B.小于3.2 g
C.大于3.2 g
(4)该化学兴趣小组同学通过查阅资料,发现大多数金属与浓硫酸都能发生反应.现取足量锌与浓硫酸反应,其化学方程式为:Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O.反应一段时间后,老师指出除了SO2,还可能生成另一种气体.请你根据锌的化学性质,推断此气体可能是________,理由是________.
ZnSO4+SO2↑+2H2O.反应一段时间后,老师指出除了SO2,还可能生成另一种气体.请你根据锌的化学性质,推断此气体可能是________,理由是________.
答案:
解析:
解析:
|
(1)Fe+H2SO4 (2)②2Cu+O2 ③CuO+H2SO4 (3)B (4)H2(或氢气) 反应一段时间后,硫酸溶液溶质的质量分数变小,锌与稀硫酸反应生成氢气(或反应一段时间后,硫酸溶液溶质的质量分数变小,Zn+H2SO4 |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目