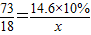题目内容
(2009?南岗区一模)氯酸钾和氯化钾的固体混合物质量为19.7g,测得钾元素的质量分数为39.6%.将其长时间加热至固体质量不再变化为止,而后将所得的固体加入足量的水中充分溶解后,再向其中加入足量的AgNO3溶液,充分反应后,生成AgCl的质量是( )
【答案】分析:欲正确解答本题,需根据质量分数公式和已知条件计算出混合物中氯酸钾和氯化钾的质量.然后根据氯酸钾和氯化钾的性质确定氯酸钾受热分解,而氯化钾不分解.然后根据化学方程式计算出生成氯化钾的质量,再加上混合物中氯化钾的质量和AgNO3反应,根据化学方程式计算出生成的AgCl的质量,再从选项中找出符合的一项即可.
解答:解:(1)氯酸钾中钾的质量分数为: ×100%≈31.8%,
×100%≈31.8%,
氯化钾中钾的质量分数为: ×100%≈52.3%,
×100%≈52.3%,
设混合物中氯酸钾的质量为x,则氯化钾的质量为19.7g-x,
∴31.8×x+52.3%×(19.7g-x)=19.7×39.6%
解之得:x≈12.2g,
则混合物中氯化钾的质量为19.7g-12.2g=7.5g.
(2)设氯酸钾分解产生氯化钾的质量为y,
2KClO3 2KCl+302↑
2KCl+302↑
245 149
12.2g y
∴
解之得:y≈7.4g.
(3)参与反应的KCl的质量为7.4g+7.5g=14.9g,设生成AgCl的质量为z,
KCl+AgNO3=AgCl↓+KNO3
74.5 143.5
14.9g z
∴
解之得:z=28.7g.
故选A.
点评:本题主要考查学生对氯酸钾和氯化钾的性质的认识,以及运用化学方程式和质量分数公式进行计算的能力.
解答:解:(1)氯酸钾中钾的质量分数为:
 ×100%≈31.8%,
×100%≈31.8%,氯化钾中钾的质量分数为:
 ×100%≈52.3%,
×100%≈52.3%,设混合物中氯酸钾的质量为x,则氯化钾的质量为19.7g-x,
∴31.8×x+52.3%×(19.7g-x)=19.7×39.6%
解之得:x≈12.2g,
则混合物中氯化钾的质量为19.7g-12.2g=7.5g.
(2)设氯酸钾分解产生氯化钾的质量为y,
2KClO3
 2KCl+302↑
2KCl+302↑245 149
12.2g y
∴

解之得:y≈7.4g.
(3)参与反应的KCl的质量为7.4g+7.5g=14.9g,设生成AgCl的质量为z,
KCl+AgNO3=AgCl↓+KNO3
74.5 143.5
14.9g z
∴

解之得:z=28.7g.
故选A.
点评:本题主要考查学生对氯酸钾和氯化钾的性质的认识,以及运用化学方程式和质量分数公式进行计算的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目