题目内容
4.南南同学看到“好想你”红枣袋中装有一袋防腐剂,品名为“504双吸剂”,其标签如图1所示.南南和北北对这包久置的“504双吸剂”固体样品很好奇,设计如下实验进行探究.【提出问题】久置固体的成分是什么?
【查阅资料】铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
【实验探究】
南南同学的方案:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放于试管中,滴加足量的稀盐酸. | 固体逐渐消失,有无色气体产生,得到浅绿色溶液. | 固体中一定含有Fe, 一定不含Fe2O3. |
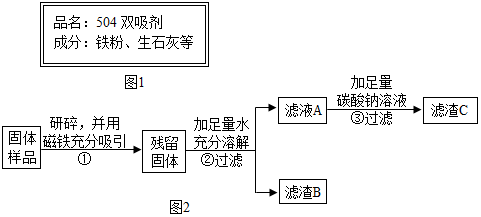
(1)步骤①样品用磁铁吸引前需经过研碎,其中研碎的目的是增大接触面积,使反应充分.
(2)步骤②中固体溶解时放出大量热,由此可以判断固体中一定含有CaO.写出该过程中的化学方程式CaO+H2O=Ca(OH)2.
(3)步骤③中反应的化学方程式是Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
北北同学对滤渣B又进行探究.
| 实验操作 | 实验现象 | 实验结论 |
| ①取滤渣B于试管中,加入适量稀盐酸 ②生成的气体通入澄清石灰水 | ①固体减少,有气泡冒出,溶液变为黄色 ②该溶液变浑浊. | 固体中一定含有CaCO3 和Fe2O3. |
【实验拓展】为增强双吸剂的吸收效果,常在双吸剂中加入一定量的NaCl,NaCl的作用可能是加快双吸剂中铁粉吸收O2的速率.
分析 [实验探究]
本题探究了防腐剂的成分,取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁,不一定不含Fe2O3理由是:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.
(1)由乙同学的设计方案可知:磁铁吸引了铁粉,②中固体溶解时放出大量热,因为生石灰溶于水生成熟石灰放出大量的热,由此可以判断固体中一定含有氧化钙;滤液A中的氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,配平即可;
对滤渣B又进行探究:①取滤渣B于试管中,加入适量稀盐酸,固体减少,有气泡冒出,溶液变为黄色;②将生成的气体通入澄清石灰水,澄清石灰水变浑浊;固体中一定含有CaCO3和Fe2O3.
[实验拓展]根据加快铁生锈的方法分析.
解答 解:南南同学的方案:取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁.北北同学不一定不含Fe2O3理由是:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.
(1)步骤①样品用磁铁吸引前需经过研碎,研碎的目的是 增大接触面积,使反应充分
(2)由北北同学的设计方案可知:磁铁吸引了铁粉,②中固体溶解时放出大量热,因为生石灰溶于水生成熟石灰放出大量的热,由此可以判断固体中一定含有氧化钙;反应的化学方程式为CaO+H2O=Ca(OH)2
(3)滤液A中的氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
对滤渣B的探究:①根据实验结论,固体中一定含有碳酸钙和氧化铁,因此取滤渣B于试管中,加入适量稀盐酸;②将生成的气体通入澄清石灰水,可看到固体减少,有气泡冒出,溶液变为黄色,澄清石灰水变浑浊;
[实验拓展]铁在盐的环境中生锈速度加快,因此为增强双吸剂的吸收效果,常在双吸剂中加入一定量的NaCl,NaCl的作用可能是 加快双吸剂中铁粉吸收O2的速率(或加快铁锈蚀的速率)
故答案为:南南同学的方案:稀盐酸; Fe;
北北同学理由:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.
(1)增大接触面积,使反应充分 (2)CaO; CaO+H2O=Ca(OH)2
(3)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
对滤渣B的探究
| 实验操作 | 实验现象 | 实验结论 |
| 稀盐酸. 澄清石灰水. | 有气泡冒出,溶液变为黄色. |
点评 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.本考点主要出现在实验题中.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 先在试管中装入高锰酸钾,再检查装置的气密性 | |
| B. | 只有二氧化锰能作过氧化氢分解的催化剂 | |
| C. | 过氧化氢与二氧化锰制取氧气的反应属于分解反应 | |
| D. | 用排水法收集氧气,先把导管伸入集气瓶中,再加热高锰酸钾 |
| A. | 常温下,木炭与氧气不反应 | |
| B. | 液氧和固态氧都是无色的 | |
| C. | 在通常情况下,氧气就能和所有的物质反应 | |
| D. | 鱼能在水中生存,说明氧气易溶于水 |
| A. | 12克 | B. | 44克 | C. | 56克 | D. | 100克 |
 常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物.
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物.(1)试管尾部放一团湿棉花的目的是提供水蒸气.
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中.说明生成的气体是氢气.
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;
猜想二:剩余固体是Fe3O4.
【实验探究】取少量黑色固体于试管中,加入足量的稀盐酸,固体全部溶解,有气泡冒出,证实猜想一是正确的.产生气泡的原因用化学方程式表示Fe+2HCl═FeCl2+H2↑
【实验结论】铁和水蒸气反应的化学方程式为3Fe+4H2O(气)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
【反思与交流】该试管中剩余固体不可能是Fe2O3,理由是Fe2O3是红棕色粉末.
| A. | 油锅着火,泼水灭火 | |
| B. | 通过降低可燃物的着火点可以灭火 | |
| C. | 任何燃料完全燃烧时,一定会生成二氧化碳 | |
| D. | 空气中混有可燃性气体,遇明火时可能发生爆炸 |
| A. | 一氧化碳气体可用作燃料 | B. | 玉米可用于酿酒 | ||
| C. | 二氧化碳气体可用来灭火 | D. | 生铁制作炒菜锅 |
 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )| A. | HCl NaOH BaCl2 Na2SO4 | B. | HCl Ba(OH)2 Na2SO4 BaCl2 | ||
| C. | H2SO4 Ba(OH)2 Na2SO4 BaCl2 | D. | H2SO4 NaOH BaCl2 Na2SO4 |