题目内容
将24.5gKClO3与8gMnO2共热,至反应不再放出气体为止,得到固体22.9g,得到气体是________,质量为________,剩余固体是________和________的混合物,其中二氧化锰________。
答案:
解析:
提示:
解析:
| 根据质量守恒定律可求得氧气的质量为24.5g+8g-22.9g=9.6g。
二氧化锰是此反应的催化剂,化学反应前后其质量并不发生改变。即混合物中除含有生成物KCl外,还有MnO2,且其质量不会减少,仍为8g。 答案:氧气 9.6g KCl MnO2 8g
|
提示:

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目


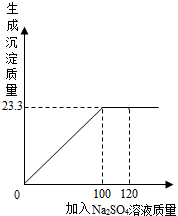 (2012?乐山三模)将24.1g由NaCl和BaCl2组成的固体混合物溶解于99.2mL水 中(P水=1g/cm3),向所得溶液中滴加质量分数为14.2%的Na2SO4溶液,至恰好完全反应.如图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算:
(2012?乐山三模)将24.1g由NaCl和BaCl2组成的固体混合物溶解于99.2mL水 中(P水=1g/cm3),向所得溶液中滴加质量分数为14.2%的Na2SO4溶液,至恰好完全反应.如图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算: