题目内容
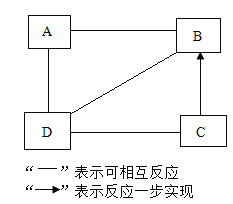
【题目】实验室有一包白色粉来,可能含有CaCO3、BaCl2、Na2SO4、NaOH和NaCl中的一种或几种,为了确定其成分,某化学兴趣小组进行了如下探究。
(查阅资料)
BaSO4固体不溶于水,也不溶于稀盐酸。
(实验探究)
甲同学设计了如下的实验方案。
实验步骤 | 实验现象 | 实验结论 |
a.取少量该粉末于试管中,加入足量水充分溶解 | 有白色沉淀 | 原粉末中一定含有碳酸钙 |
b.将步骤a试管中物质过滤,向滤液中滴加酚酞溶液 | 溶液变红 | 原粉末中一定含有_____ |
乙同学认为甲同学步骤a的结论不一定正确,其理由是_____(用化学方程式表示),他补充了如下实验,取白色沉淀于试管中,加入足量稀盐酸,观察到有气泡产生且_____,从而得出结论:步骤a中得到的白色沉淀全部是 CaCO3。丙同学取甲同学步b中已变红的溶液,向其中逐滴滴入稀硫酸,发现有白色沉淀生成溶液褪色。溶液褪色的原因用化学方程式表示为_____。
(总结归纳)
通过以上探究,原白色粉末中无法确定的成分是_____。
【答案】NaOH ![]() 沉淀完全溶解
沉淀完全溶解 ![]() NaCl
NaCl
【解析】
实验探究:
a.取少量该粉末于试管中,加入足量水充分溶解有白色沉淀。原粉末中一定含有碳酸钙;
b.将步骤a试管中物质过滤,向滤液中滴加酚酞溶液,溶液变红,溶液一定显碱性,原粉末中一定含有:氢氧化钠;
乙同学认为甲同学步骤a的结论不一定正确,其理由是氯化钡与硫酸钠反应产生硫酸钡沉淀和氯化钠:![]() ,他补充了如下实验,取白色沉淀于试管中,加入足量稀盐酸,观察到有气泡产生且沉淀全部溶解,从而得出结论:步骤a中得到的白色沉淀全部是 CaCO3,没有硫酸钡,因为硫酸钡遇盐酸不溶解,说明原固体粉末中没有硫酸钠;
,他补充了如下实验,取白色沉淀于试管中,加入足量稀盐酸,观察到有气泡产生且沉淀全部溶解,从而得出结论:步骤a中得到的白色沉淀全部是 CaCO3,没有硫酸钡,因为硫酸钡遇盐酸不溶解,说明原固体粉末中没有硫酸钠;
丙同学取甲同学步骤b中已变红的溶液,向其中逐滴滴入稀硫酸,稀硫酸与氯化钡反应产生硫酸钡沉淀,发现有白色沉淀生成溶液褪色,则固体粉末中一定有氯化钡,溶液褪色的原因是氢氧化钠与稀硫酸反应产生硫酸钠溶液(显中性)和水![]() 。
。
总结归纳:
通过以上探究,原白色粉末中一定有碳酸钙、氢氧化钠、氯化钡;一定没有硫酸钠;无法确定氯化钠是否存在,因为氯化钠对实验结果没有影响。

 阅读快车系列答案
阅读快车系列答案【题目】某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动。
(提出问题)这种淡黄色粉末是什么?有什么性质和用途?
(查阅资料)①硫是淡黄色粉末,不溶于水;②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成碱和一种气体;在呼吸面具中和潜水艇里常用作供氧剂。
(猜想与探究)猜想:淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物。
探究:过氧化钠与水反应的生成物的成分。
(实验与结论)
实验操作 | 实验现象 | 实验结论 | |
猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 | _____ | 猜想a、c不成立,猜想b成立。 |
探究 | ①用带火星的木条伸入过氧化钠与水反应的试管中 | 木条复燃 | 生成物有_____ |
②往①试管内的溶液中滴加_____ | _____ | 生成物有氢氧化钠 |
(继续探究)小组的同学对过氧化钠能作为供氧剂也很感兴趣,大家讨论认为可能是CO2在常温下能与过氧化钠反应有关,于是设计如图所示的装置继续实验探究。
实验操作 | 实验现象 | 实验结论 |
①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 | 木条复燃 | CO2在常温下能与过氧化钠反应,该反应的化学方程式为:_____ |
②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的气体通入澄清石灰水中 | 有气泡产生石灰水变浑浊 |
【题目】小文同学取瑞金市石灰石样品20g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示。
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 1.1 | 2.2 | m | 4.4 | 4.4 |
试求:
(1)m的值为_______;
(2)第______次为恰好完全反应;
(3)计算该石灰石样品中碳酸钙的质量分数。(写出计算过程)______