题目内容
20℃时,将一种可溶性盐与一种不溶性固体混合物30g投入40g水中,搅拌溶解,过滤、剩余15.6g固体,再将15.6g固体加入40g水再搅拌、过滤后还剩5g固体,求20℃时,混合物中可溶性盐的溶解度是________g。
答案:
解析:
提示:
解析:
| 第一次30g固体溶解在40g水中,剩余15.6g,溶解30g-15.6g=14.4g,即混合物中可溶性盐溶解了14.4g;第二次再加40g水,15.6g剩余固体中又溶解了15.6g-5g=10.6g,第二次操作说明剩余的15.6g固体中还有未溶解的可溶性盐,也就说明第一次操作中40g水溶解14.4g可溶性盐已达饱和,这就是解题关键,第二次操作只为帮助说明第一次得到的是饱和溶液,所以有:饱和溶液中溶质为14.4g,溶剂为40g。
溶解度为S,有
|
提示:

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
酸、碱、盐知识是中学化学的重要组成部分,亮亮同学针对本部分内容进行了一系列的探究学习.
(1)溶解性表是学习化学的重要工具.亮亮同学研究了“部分酸、碱、盐在20℃时的溶解性”(如右表),认为其中的 (填物质名称)是一种微溶于水的盐, (填物质化学式)是一种可溶于水的碱.
(2)下图是稀硫酸和氢氧化钠溶液反应的微观示意图,从粒子角度分析,该反应发生的实质是 .
(3)硫酸是中学常见的酸.亮亮欲将50g 98%的浓硫酸稀释成24、5%的稀硫酸,需量取水 g,在浓硫酸的稀释过程中,亮亮的操作方法应为 .
(4)在实验室,亮亮发现一瓶氢氧化钠固体试剂因敞口放置,已部分发生了变质.
①为得知该瓶药品的变质程度,亮亮设计了如下实验方案:取10g样品(假设部分变质后的样品组成为氢氧化钠和碳酸钠),加入100g稀硫酸(过量)使之充分反应,发现反应后剩余溶液的质量为107.8g.请计算该样品中氢氧化钠的质量分数.
(1)溶解性表是学习化学的重要工具.亮亮同学研究了“部分酸、碱、盐在20℃时的溶解性”(如右表),认为其中的
| OH- | N
|
Cl- | C
|
S
| |||||||
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |||||||
| Ca2+ | 微 | 溶 | 溶 | 不 | 微 | ||||||
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 | ||||||
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |

(3)硫酸是中学常见的酸.亮亮欲将50g 98%的浓硫酸稀释成24、5%的稀硫酸,需量取水
(4)在实验室,亮亮发现一瓶氢氧化钠固体试剂因敞口放置,已部分发生了变质.
①为得知该瓶药品的变质程度,亮亮设计了如下实验方案:取10g样品(假设部分变质后的样品组成为氢氧化钠和碳酸钠),加入100g稀硫酸(过量)使之充分反应,发现反应后剩余溶液的质量为107.8g.请计算该样品中氢氧化钠的质量分数.
酸、碱、盐知识是中学化学的重要组成部分,亮亮同学针对本部分内容进行了一系列的探究学习.
(1)溶解性表是学习化学的重要工具.亮亮同学研究了“部分酸、碱、盐在20℃时的溶解性”(如右表),认为其中的______(填物质名称)是一种微溶于水的盐,______(填物质化学式)是一种可溶于水的碱.
| OH- | N | Cl- | C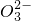 | S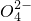 | |
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |
| Ca2+ | 微 | 溶 | 溶 | 不 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |

(3)硫酸是中学常见的酸.亮亮欲将50g 98%的浓硫酸稀释成24、5%的稀硫酸,需量取水______g,在浓硫酸的稀释过程中,亮亮的操作方法应为______.
(4)在实验室,亮亮发现一瓶氢氧化钠固体试剂因敞口放置,已部分发生了变质.
①为得知该瓶药品的变质程度,亮亮设计了如下实验方案:取10g样品(假设部分变质后的样品组成为氢氧化钠和碳酸钠),加入100g稀硫酸(过量)使之充分反应,发现反应后剩余溶液的质量为107.8g.请计算该样品中氢氧化钠的质量分数.
酸、碱、盐知识是中学化学的重要组成部分,亮亮同学针对本部分内容进行了一系列的探究学习.
(1)溶解性表是学习化学的重要工具.亮亮同学研究了“部分酸、碱、盐在20℃时的溶解性”(如右表),认为其中的______(填物质名称)是一种微溶于水的盐,______(填物质化学式)是一种可溶于水的碱.
(2)下图是稀硫酸和氢氧化钠溶液反应的微观示意图,从粒子角度分析,该反应发生的实质是______.
(3)硫酸是中学常见的酸.亮亮欲将50g 98%的浓硫酸稀释成24、5%的稀硫酸,需量取水______g,在浓硫酸的稀释过程中,亮亮的操作方法应为______.
(4)在实验室,亮亮发现一瓶氢氧化钠固体试剂因敞口放置,已部分发生了变质.
①为得知该瓶药品的变质程度,亮亮设计了如下实验方案:取10g样品(假设部分变质后的样品组成为氢氧化钠和碳酸钠),加入100g稀硫酸(过量)使之充分反应,发现反应后剩余溶液的质量为107.8g.请计算该样品中氢氧化钠的质量分数.
(1)溶解性表是学习化学的重要工具.亮亮同学研究了“部分酸、碱、盐在20℃时的溶解性”(如右表),认为其中的______(填物质名称)是一种微溶于水的盐,______(填物质化学式)是一种可溶于水的碱.
| OH- | N | Cl- | C | S | |
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |
| Ca2+ | 微 | 溶 | 溶 | 不 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |

(3)硫酸是中学常见的酸.亮亮欲将50g 98%的浓硫酸稀释成24、5%的稀硫酸,需量取水______g,在浓硫酸的稀释过程中,亮亮的操作方法应为______.
(4)在实验室,亮亮发现一瓶氢氧化钠固体试剂因敞口放置,已部分发生了变质.
①为得知该瓶药品的变质程度,亮亮设计了如下实验方案:取10g样品(假设部分变质后的样品组成为氢氧化钠和碳酸钠),加入100g稀硫酸(过量)使之充分反应,发现反应后剩余溶液的质量为107.8g.请计算该样品中氢氧化钠的质量分数.