题目内容
某化学兴趣小组的同学在实验室配制溶质质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。下图表示用该氢氧化钠溶液与10 g某稀盐酸发生反应后溶液温度的变化情况。

⑴配制150克8%的氢氧化钠溶液时主要步骤有______、称取、_____、________、装瓶贴标签。
⑵根据曲线判断,该反应过程中_________(填放热或吸热);A点到B点过程中溶液pH_________(填
变大或变小);当加入氢氧化钠溶液的质量为 g,反应恰好完全进行。
⑶计算稀盐酸中溶质的质量分数。
⑷计算恰好完全反应时所得溶液中溶质的质量分数是多少?
【答案】
(1)计算、量取、溶解 (2)放热、变大、20克或20g
(2) 14.6%(2分) (3) 7.8%
【解析】
试题分析:⑴配制溶液的操作步骤为计算、称取、量取、溶解、装瓶贴标签;⑵根据图示可知,反应
放热,碱性变大,温度达到最高后温度下降,说明已经没有了热量补给,反应停止,所以当加入氢氧
化钠溶液的质量为20g时,反应恰好完全进行;
⑶、(4)由题,设稀盐酸中溶质的质量分数为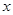 ,生成的氯化钠质量为
,生成的氯化钠质量为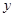
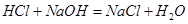
36.5 40 58.5
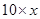
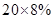
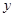
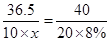
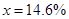
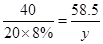
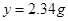
恰好完全反应时所得溶液的质量为:氢氧化钠溶液的质量加盐酸的质量=10g+20g=30g
所以恰好完全反应时所得溶液中溶质的质量分数是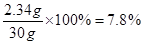
考点:化学方程式的计算
点评:这是化学反应联系方程式的计算题,这种题目是每年中考的压轴题,必考题,这类题目的难点
在于把坐标曲线表示的意义和题干联系起来。

练习册系列答案
相关题目
 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.


 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.