题目内容
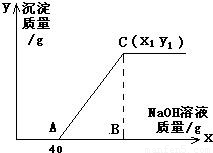
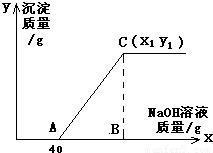
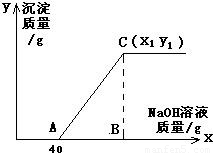
有盐酸和氯化铜的混合溶液共100g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液,生成的沉淀与加入的10%的氢氧化钠溶液的质量关系如如图所示.若氯化铜在原混合溶液中的质量分数为13.5%.

求:(1)原混合溶液中HCl的质量分数;
(2)C点的坐标(x1、y1)为多少?

求:(1)原混合溶液中HCl的质量分数;
(2)C点的坐标(x1、y1)为多少?
(1)由关系图可知,与混合溶液中盐酸发生反应的氢氧化钠溶液的质量为40g,其中氢氧化钠的质量=40g×10%=4g;
设反应消耗HCl的质量为x
NaOH+HCl═NaCl+H2O
40 36.5
4g x
=
x=3.65g
原混合溶液中HCl的质量分数=
×100%=3.65%
(2)混合溶液中含氯化铜的质量=100g×13.5%=13.5g
设反应消耗氢氧化钠的质量为y,反应生成沉淀氢氧化铜的质量为y1
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
135 80 98
13.5g y y1
=
y=8g
=
y1=9.8g
整个过程所消耗氢氧化钠溶液的总质量x1=40g+8g÷10%=120g
答:(1)原混合溶液中HCl的质量分数为3.65%;(2)C点的坐标为(120,9.8).
设反应消耗HCl的质量为x
NaOH+HCl═NaCl+H2O
40 36.5
4g x
| 40 |
| 4g |
| 36.5 |
| x |
原混合溶液中HCl的质量分数=
| 3.65g |
| 100g |
(2)混合溶液中含氯化铜的质量=100g×13.5%=13.5g
设反应消耗氢氧化钠的质量为y,反应生成沉淀氢氧化铜的质量为y1
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
135 80 98
13.5g y y1
| 135 |
| 13.5g |
| 80 |
| y |
| 135 |
| 13.5g |
| 98 |
| y1 |
整个过程所消耗氢氧化钠溶液的总质量x1=40g+8g÷10%=120g
答:(1)原混合溶液中HCl的质量分数为3.65%;(2)C点的坐标为(120,9.8).

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
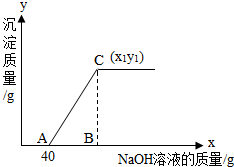 有盐酸和氯化铜的混合溶液共100g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液,生成的沉淀与加入的10%的氢氧化钠溶液的质量关系如如图所示.若氯化铜在原混合溶液中的质量分数为13.5%.
有盐酸和氯化铜的混合溶液共100g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液,生成的沉淀与加入的10%的氢氧化钠溶液的质量关系如如图所示.若氯化铜在原混合溶液中的质量分数为13.5%.