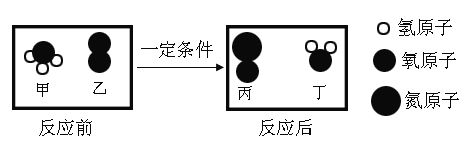
题目内容
【题目】如图所示是三种物质的溶解度曲线。

请回答:
(1)30℃时溶解度最大的是_____
(2)80℃时硝酸钠饱和溶液的溶质质量分数为_____。使硝酸钠不饱和溶液变为饱和溶液,可采取的措施有_____(写一种)。
(3)某硝酸钾固体中混有少量硫酸铈杂质,分离提纯硝酸钾的操作是:配成高温下的硝酸钾饱和溶液、_____、过滤、洗涤、干燥。
【答案】硝酸钠 60% 加硝酸钠溶质或降低温度或蒸发水 降温结晶
【解析】
(1)由图可知,横坐标为30℃时,三条曲线纵坐标最大的是硝酸钠曲线,即30℃时,硝酸钠溶解度最大,故填写:硝酸钠;
(2)由图可知,横坐标为80℃时,硝酸钠曲线的纵坐标为150g,根据饱和溶液的溶解度和溶质质量分数关系:![]() ×100%可知,80℃时硝酸钠饱和溶液的溶质质量分数为:
×100%可知,80℃时硝酸钠饱和溶液的溶质质量分数为:![]() ×100%=60%,故填写:60%;
×100%=60%,故填写:60%;
由图可知,硝酸钠的溶解度曲线变化趋势是:随温度的升高,而升高,根据一般物质不饱和溶液变饱和溶液的三种方法可得,使硝酸钠不饱和溶液变为饱和溶液,可采取的措施有加硝酸钠溶质或降低温度或蒸发溶剂,故填写:加硝酸钠溶质或降低温度或蒸发水;
(3)由图可知,硝酸钾的溶解度曲线变化趋势是:随温度的升高,而升高,硫酸铈的溶解度曲线的变化趋势是:随温度的升高,而降低,因此,某硝酸钾固体中混有少量硫酸铈杂质,分离提纯硝酸钾,可以采用降温结晶,操作方法是:配成高温下的硝酸钾饱和溶液、降温结晶、过滤、洗涤、干燥,故填写:降温结晶。

【题目】当把燃着的小蜡烛放入一个集气瓶中并塞紧胶塞时,蜡烛一会儿就熄灭了。那么,蜡烛为什么会熄灭呢?某化学兴趣小组进行了如下探究,请你填答相关空格。
[提出猜想]猜想I:蜡烛燃烧把集气瓶内的氧气耗尽,导致蜡烛熄灭。
猜想II:蜡烛燃烧随集气瓶内氧气含量降低而变弱,放出的热量减少,使温度降至蜡烛的着火点以下,导致蜡烛熄灭。
猜想Ⅲ:蜡烛燃烧产生的二氧化碳能灭火,导致蜡烛熄灭。
[进行实验]小组设计如下图所示的实验装置,并进行实验来验证猜想。
| 实验操作 | 实验现象 |
点燃蜡烛并连同胶塞上的其它仪器药品一起放入集气瓶中,塞紧胶塞。 | 蜡烛火焰逐渐变微弱最终________________, | |
蜡烛熄灭并静置冷却后,将铜丝上提,使盛白磷的铜网勺高于试管口,试管倒下,水流出。 | 一会儿后,白磷着火燃烧,有大量_____________产生。 |
[分析及结论]
(1)蜡烛熄灭前,要让白磷浸没在小试管所盛的水中,目的是________________。
(2)生石灰遇水发生化学反应放出大量的热,集气瓶中装入- -些生石灰的设计,目的是让它发生反应提高瓶内的________________。
(3)瓶内的白磷能燃烧,证明猜想______________和______________不能成立。我们根据成立的猜想认为,应该把“燃烧需要氧气”这一燃烧发生的条件补充完善为“______________”。
【题目】某钙片的标签如下图,且知钙片成分中只有碳酸钙中含有钙元素。某实验小组为测定其真实的含钙量做了如下实验,每次取10片钙片放入已称量的含足量盐酸的烧杯中,发生的化学反应是:钙片中的碳酸钙和稀盐酸反应生成二氧化碳气体逸出,充分反应后再称取烧杯和剩余物质的总质量,数据如下表:

物质的质量 | |
反应前:烧杯+盐酸 | 22g |
10片钙片 | 8g |
反应后:烧杯+剩余物 | 26.7g |
(1)列式计算反应中生成二氧化碳的质量为_______________。
(2)计算每片钙片中钙的实际质量__________。(要求写出解答过程)
(3)请通过计算推断此标签中的含钙量是_____(填“虚假”或“真实”)的。