题目内容
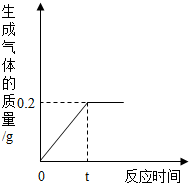 (2012?奉贤区模拟)为测定某粗锌样品中锌的质量分数,取10g粗锌样品(含少量杂质,且杂质不溶于水,也不与酸反应)于烧杯中,向其中加入足量的稀硫酸,生成气体的质量与反应时间的关系如图所示,试回答下列问题:
(2012?奉贤区模拟)为测定某粗锌样品中锌的质量分数,取10g粗锌样品(含少量杂质,且杂质不溶于水,也不与酸反应)于烧杯中,向其中加入足量的稀硫酸,生成气体的质量与反应时间的关系如图所示,试回答下列问题:(1)计算10克粗锌样品中锌的物质的量(根据化学方程式列式计算);
(3)该粗锌样品中锌的质量分数为
65%
65%
.分析:(1)图象中曲线折点表示恰好完全反应,此时生成氢气的质量为0.2g,据此分析解答;
(2)根据反应的化学方程式,由放出氢气的质量计算样品中锌的质量,依据锌的质量计算锌的质量分数;
(2)根据反应的化学方程式,由放出氢气的质量计算样品中锌的质量,依据锌的质量计算锌的质量分数;
解答:解:(1)锌与硫酸恰好完全反应时即曲线的折点,此时所产生氢气的质量为0.2g;
设锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
=
x=6.5g
所以锌的物质的量是
=0.1mol
(2)该粗锌样品中锌的质量分数为
×100%=65%
故答案为:(1)10克粗锌样品中锌的物质的量是0.1mol;(2)65%;
设锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
| 65 |
| 2 |
| x |
| 0.2g |
x=6.5g
所以锌的物质的量是
| 6.5g |
| 65g/mol |
(2)该粗锌样品中锌的质量分数为
| 6.5g |
| 10g |
故答案为:(1)10克粗锌样品中锌的物质的量是0.1mol;(2)65%;
点评:解答此类问题的根本点在于对反应图象的曲线进行分析,曲线的折点表示此时恰好完全反应.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
 (2012?奉贤区二模)一瓶失去标签的无色溶液A,可能是NaCl、KNO3、Na2CO3和K2SO4溶液中的一种.现设计了如图实验来确定其组成:
(2012?奉贤区二模)一瓶失去标签的无色溶液A,可能是NaCl、KNO3、Na2CO3和K2SO4溶液中的一种.现设计了如图实验来确定其组成: