题目内容
12.下列两个化学方程式都有错误:Fe+O2$\frac{\underline{\;点燃\;}}{\;}$FeO2 Mg+O2$\frac{\underline{\;点燃\;}}{\;}$MgO,其中违背了书写化学方程式遵循客观事实的原则,违背了书写化学方程式遵循质量守恒定律的原则.分析 书写化学方程式时,要遵循客观事实,同时要遵循质量守恒定律.
解答 解:铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2点燃?Fe3O4,而Fe+O2$\frac{\underline{\;点燃\;}}{\;}$FeO2中,生成物是FeO2,违背了客观事实;
镁在氧气中燃烧的化学方程式为:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO,而Mg+O2$\frac{\underline{\;点燃\;}}{\;}$MgO中没有配平,不遵循质量守恒定律,即违背了质量守恒定律.
故填:遵循客观事实;遵循质量守恒定律.
点评 书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.在空气中,与人类关系最密切的当属氧气.下列说法正确的是( )
| A. | 带火星的木条在氧气中能够复燃,说明氧气能支持燃烧 | |
| B. | 铁丝在氧气中剧烈燃烧,火星四射,说明氧气具有可燃性 | |
| C. | 氧气的化学性质非常活泼,能与所有的物质发生化学反应 | |
| D. | 用氯酸钾和二氧化锰制取氧气的反应不是分解反应 |
18.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是( )
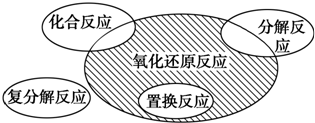

| A. | Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$ 2Fe+3CO2 | B. | 2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑ | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | FeCl3+3NaOH═Fe(OH)3↓+3NaCl |
15.甲、乙、丙、丁四位同学在探究碱溶液与酚酞作用的实验时,发现了一个意外现象:
将酚酞试液滴入氢氧化钠溶液,溶液变成了红色,一会儿红色就消失了.这是什么原因呢?他们依据所学的科学知识,分别对这种意外现象的成因做了如下猜想:
甲:可能是酚酞变质的缘故;
乙:可能是氢氧化钠溶液与空气中二氧化碳反应的缘故;
丙:可能是酚酞与空气中氧气反应,使红色消失的缘故;
丁:可能与氢氧化钠溶液质量分数大小有关,质量分数大的溶液中红色会消失.
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是若酚酞试剂变质,就不可能出现遇氢氧化钠溶液变红的现象.
丙同学认为乙同学的猜想也不正确,他的理由是生成的碳酸钠溶液显碱性,也可使酚酞试剂变红.
(2)为证实丙同学的猜想,还需作如下实验,请完成表.
(3)通过以上实验,四位同学看到:溶液先变成红色,一会儿红色又消失.因此酚酞红色褪去与氧气无关.若丁同学的猜想正确,设计如下实验证明并完成有关问题:
将酚酞试液滴入氢氧化钠溶液,溶液变成了红色,一会儿红色就消失了.这是什么原因呢?他们依据所学的科学知识,分别对这种意外现象的成因做了如下猜想:
甲:可能是酚酞变质的缘故;
乙:可能是氢氧化钠溶液与空气中二氧化碳反应的缘故;
丙:可能是酚酞与空气中氧气反应,使红色消失的缘故;
丁:可能与氢氧化钠溶液质量分数大小有关,质量分数大的溶液中红色会消失.
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是若酚酞试剂变质,就不可能出现遇氢氧化钠溶液变红的现象.
丙同学认为乙同学的猜想也不正确,他的理由是生成的碳酸钠溶液显碱性,也可使酚酞试剂变红.
(2)为证实丙同学的猜想,还需作如下实验,请完成表.
| 实验步骤 | 目的 |
| ①用煮沸过的蒸馏水配制氢氧化钠溶液. | 用煮沸过的蒸馏水:排出水中溶解的氧气 |
| ②在氢氧化钠溶液中滴入酚酞,并在上方滴一些植物油 | 滴一些植物油:隔绝空气 |
| 实验方法 | 预计观察到的现象 |
| 方案一:分别配制不同质量分数的氢氧化钠溶液,然后各滴加2滴酚酞试液. | 将滴有酚酞试液的质量分数大的氢氧化钠溶液加水稀释,溶液变红,说明与氢氧化钠溶液质量分数大小有关 |
4.人类生活中的下列用品,属于天然材料的是( )
| A. | 塑料制品 | B. | 钢铁制品 | C. | 天然木制品 | D. | 玻璃制品 |
1.下列物质在敞口容器中发生反应,容器内物质的总质量在反应前后不变的是( )
| A. | 石灰石放到稀盐酸中 | B. | 氢氧化钠溶液与硫酸铜溶液混合 | ||
| C. | 铁钉生锈 | D. | 木炭燃烧 |
2.下列是四种粒子的结构示意图,下列说法正确的是( )


| A. | ①和③属于同种元素 | B. | ①和④表示的元素是金属元素 | ||
| C. | ②和③化学性质相似 | D. | ①和②表示的是阳离子 |
 近年来,因建设“PX”项目而引发的争议时有发生.PX是一种重要的化工原料,从化纤织物到食品包装,从医疗设备到家用电器,都要用到它的合成产物.PX的化学名称为对二甲苯,它是一种低毒化合物,毒性略高于酒精.
近年来,因建设“PX”项目而引发的争议时有发生.PX是一种重要的化工原料,从化纤织物到食品包装,从医疗设备到家用电器,都要用到它的合成产物.PX的化学名称为对二甲苯,它是一种低毒化合物,毒性略高于酒精. ”代表碳原子,“
”代表碳原子,“ ”代表氢原子.试根据分子模型写出对二甲苯的化学式C8H10.
”代表氢原子.试根据分子模型写出对二甲苯的化学式C8H10.