题目内容
3.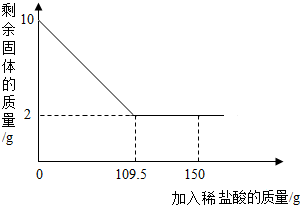 有一赤铁矿样品(主要成分为Fe2O3),某学校化学兴趣小组为了测得样品中氧化铁的质量分数,进行了如下探究:小明取10g赤铁矿样品(杂质不溶于水和酸),不断加入稀盐酸到固体的质量不再减少,加入稀盐酸的量如图所示:求:
有一赤铁矿样品(主要成分为Fe2O3),某学校化学兴趣小组为了测得样品中氧化铁的质量分数,进行了如下探究:小明取10g赤铁矿样品(杂质不溶于水和酸),不断加入稀盐酸到固体的质量不再减少,加入稀盐酸的量如图所示:求:(1)赤铁矿中氧化铁的质量分数是80%;
(2)计算所使用的稀盐酸的溶质质量分数.
分析 根据图可知,10g样品中杂质的质量为2g,则氧化铁的质量为8g,可求赤铁矿中氧化铁的质量分数.根据8g氧化铁和109.5g盐酸结合对应的化学方程式求算稀盐酸中溶质的质量,进而求算其质量分数.
解答 解:
(1)根据固体最后剩余2g可知,杂质的质量为2g,则氧化铁的质量为8g
赤铁矿中氧化铁的质量分数为$\frac{8g}{10g}$×100%=80%;
(2)设参加反应的盐酸的质量为x
Fe2O3+6HCl=2FeCl3+3H2O
160 219
8g x
$\frac{160}{219}$=$\frac{8g}{x}$
x=10.95g
所以所使用的稀盐酸的溶质质量分数为:$\frac{10.95g}{109.5g}$×100%=10%
答:(1)赤铁矿中氧化铁的质量分数是 80%;
(2)所使用的稀盐酸的溶质质量分数为10%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.在Cu(NO3)2和AgNO3的混合溶液中加入一定量的Zn,充分反应后过滤,留在滤纸上的固体一定( )
| A. | 有Zn | B. | 有ZnCuAg | C. | 有Cu和Ag | D. | 有Ag |
8. 2008年“中国水周”活动的宣传主题为“发展水利,改善民生”.
2008年“中国水周”活动的宣传主题为“发展水利,改善民生”.
(1)①水属于(填“属于”或“不属于”)六大类营养素之一.
②保持水的化学性质的最小粒子是水分子.
(2)有一杯主要含有MgCl2和CaCl2的硬水.某兴趣小组设计出软化水的部分实验方案,请你一起来完成.
可供选用的物质有:Ca(OH)2溶液、NaOH溶液、饱和Na2CO3溶液、肥皂水
 2008年“中国水周”活动的宣传主题为“发展水利,改善民生”.
2008年“中国水周”活动的宣传主题为“发展水利,改善民生”.(1)①水属于(填“属于”或“不属于”)六大类营养素之一.
②保持水的化学性质的最小粒子是水分子.
(2)有一杯主要含有MgCl2和CaCl2的硬水.某兴趣小组设计出软化水的部分实验方案,请你一起来完成.
可供选用的物质有:Ca(OH)2溶液、NaOH溶液、饱和Na2CO3溶液、肥皂水
| 实验步骤 | 实验现象 | 结论或化学方程式 |
| ①取少量水样于试管中,滴加氢氧化钙溶液,直到不再产生沉淀 | 有白色沉淀产生 | MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2 |
| ②继续向上述试管中滴加 饱和Na2CO3溶液直到不再产生沉淀 | 有白色沉淀产生 | Na2CO3+CaCl2═CaCO3↓+2NaCl |
| ③过滤 | 滤液澄清 | --- |
| ④向滤液中滴加适量的肥皂水 | 产生大量泡沫 | 证明硬水已软化 |
13.在“宏观-微观-符号”之间建立联系,是化学学科特有的思维方式.如图是某反应的微观示意图,下列说法正确的是( )


| A. | 反应生成的丙、丁物质的质量比为22:9 | |
| B. | 乙、丙、丁均为氧化物 | |
| C. | 参加反应的甲、乙分子个数比为1:1 | |
| D. | 该反应属于置换反应 |
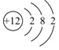 ,镁元素位于周期表中第三周期.;
,镁元素位于周期表中第三周期.; A-F是初中化学中常见的六种物质,其中B、C组成元素相同,C、D、E、F是不同类别的化合物,D和E的溶液均呈碱性,且E可用作农业上改良酸性土壤,它们相互间的关系如图所示,(图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质转化为另一物质,部分反应物、生成物及反应条件已略去),请回答:
A-F是初中化学中常见的六种物质,其中B、C组成元素相同,C、D、E、F是不同类别的化合物,D和E的溶液均呈碱性,且E可用作农业上改良酸性土壤,它们相互间的关系如图所示,(图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质转化为另一物质,部分反应物、生成物及反应条件已略去),请回答: