题目内容
下列说法符合质量守恒定律的是( )
| A、4g碳和8g氧气反应后生成12g二氧化碳 |
| B、电解9g水,生成3g氢气和6g氧气 |
| C、3g镁和2g氧气完全反应后生成5g氧化镁 |
| D、21g铁丝在6g氧气中燃烧生成27g四氧化三铁 |
考点:质量守恒定律及其应用
专题:化学用语和质量守恒定律
分析:质量守恒定律是物质在发生化学变化中表现出来的一种规律;发生化学变化时要对反应前后物质的质量关系进行计算判断,即反应时是否符合固定的质量比,据此分析解答即可.
解答:解:A、碳和氧气反应的化学方程式为:C+O2
CO2,可知,碳、氧气、二氧化碳的质量比为:(12):(16×2):(12+16×2)=3:8:11,4g碳和8g氧气反应生成11g二氧化碳,故选项说法错误.
B、电解水的化学方程式为:2H2O
2H2↑+O2↑.可知水、氢气、氧气的质量比为:36:4:32=9:1:8,故电解9g水,应生成1g氢气8g氧气,故B说法错误;
C、镁在氧气中燃烧的化学方程式为:2Mg+O2
2MgO,可知镁、氧气、氧化镁三者的质量比为:48:32:80=3:2:5,3g镁和2g氧气完全反应后生成5g氧化镁,故C说法正确;
D、铁丝在氧气中燃烧的化学方程式为:3Fe+2O2
Fe3O4,可知铁、氧气、四氧化三铁三者的质量比
为:(56×3):(16×4):(56×3+16×4)=168:64:232=21:8:29,故21g铁丝应与8g氧气才能完全反应,故D说法错误;
故选C
| ||
B、电解水的化学方程式为:2H2O
| ||
C、镁在氧气中燃烧的化学方程式为:2Mg+O2
| ||
D、铁丝在氧气中燃烧的化学方程式为:3Fe+2O2
| ||
为:(56×3):(16×4):(56×3+16×4)=168:64:232=21:8:29,故21g铁丝应与8g氧气才能完全反应,故D说法错误;
故选C
点评:本题主要考查学生运用质量守恒定律进行推断的能力.当两种反应物质量都已知,求生成物的质量时要先判断反应物是否恰好完全反应.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
下列做法不符合“低碳生活”的是( )
| A、开发新能源,代替传统能源 |
| B、在生产和生活中提倡使用节能技术和节能用具 |
| C、大力发展以煤炭为原料的火力发电,促进经济发展 |
| D、提倡乘坐公交车、骑自行车或步行的方式出行 |
下列物质的转化不能通过一步反应就实现的是( )
| A、Cu→Cu(OH)2 |
| B、Zn→ZnCl2 |
| C、CuSO4→FeSO4 |
| D、Fe2O3→FeCl3 |
有一种粒子的结构示意图为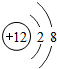 下列说法不正确的是( )
下列说法不正确的是( )
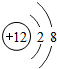 下列说法不正确的是( )
下列说法不正确的是( )| A、该粒子是带两个单位正电荷的阳离子 |
| B、该元素是一种金属元素 |
| C、该元素在化合物中的化合价为+2 |
| D、该元素的原子核外有两个电子层 |
现代生活居家活动中,属于物理变化的是( )
| A、生米煮成熟饭 |
| B、擦燃火柴 |
| C、鲜榨西瓜汁 |
| D、液化气燃烧 |
各种洗涤剂广泛进入人们的生活中,下列洗涤中所用洗涤剂具有乳化功能的是( )
| A、用汽油除去衣服上的油污 |
| B、用沐浴露清洗皮肤上的油脂 |
| C、用水洗去盘子中的水果渣 |
| D、用醋洗去水壶的水垢 |
电解水时,若正极得到16g氧气,则负极得到氢气的质量是( )
| A、16g | B、32g |
| C、2g | D、1g |