题目内容
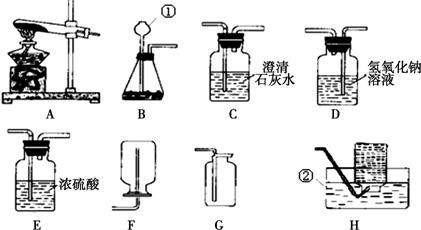
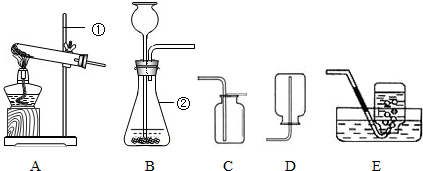
根据下列装置图,回答有关问题:

(1)利用上图中A、C装置的组合可以制取某种气体,实验室制取该气体的化学方程式是
,验满方法是 。
(2)实验室通常利用上图中 装置的组合制取二氧化碳(选填字母),该反应的化学方程式为 。
①为了得到纯净、干燥的二氧化碳气体,除杂装置(如下图)的导管按气流方向连接顺序是 (选填字母)。

A.a→b→c→d B.b→a→c→d
C.c→d→a→b D.d→c→b→a
②常用澄清石灰水检验二氧化碳的存在,该反应的化学方程式为
(1)2KClO3△2KCl+3O2↑ (或2KMnO4 △ K2MnO4+MnO2+O2↑)
将带火星的木条靠近集气瓶口,若木条迅速复燃,证明已收集满氧气
(2) BC CaCO3+2HCl===CaCl2+CO2↑+H2O
① C ② CO2+Ca(OH)2===CaCO3↓+ H2O
【解析】
试题分析:(1)由于装置A属于“固体加热型”的发生装置,而装置C为向上排空气法的收集装置,故用此装置组合可制取氧气,因为高锰酸钾固体在受热的条件下分解,生成锰酸钾、二氧化锰和氧气,故反应的化学方程式为2KMnO4 K2MnO4+MnO2+O2↑;或氯酸钾固体在二氧化锰固体做催化剂的作用下,受热分解生成氯化钾和氧气,故反应的化学方程式为2KClO3△2KCl+3O2↑;且由于氧气的密度比空气大,故可用C装置来收集。由于氧气具有助燃性,能使带火星的小木条复燃,故可将带火星的木条伸到集气瓶口,若木条复燃,则证明集气瓶中已收集满氧气。
K2MnO4+MnO2+O2↑;或氯酸钾固体在二氧化锰固体做催化剂的作用下,受热分解生成氯化钾和氧气,故反应的化学方程式为2KClO3△2KCl+3O2↑;且由于氧气的密度比空气大,故可用C装置来收集。由于氧气具有助燃性,能使带火星的小木条复燃,故可将带火星的木条伸到集气瓶口,若木条复燃,则证明集气瓶中已收集满氧气。
(2)实验室制取二氧化碳,一般选用石灰石或大理石和稀盐酸在常温下反应,生成氯化钙、水和二氧化碳,故反应的方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;由此可知,该反应属于固液体在常温下的反应,故发生装置应选B;由于生成的二氧化碳能溶于水,且能与水反应,故不能用排水法收集;由于二氧化碳的密度比空气大,故可用向上排空气法C收集。
①由于使用了盐酸制取二氧化碳,而盐酸具有挥发性,故制得的二氧化碳中会混有一定量的氯化氢气体,为了得到纯净、干燥的二氧化碳气体,需先除去氯化氢气体,再除水(干燥),故要先通过饱和碳酸氢钠,再通过浓硫酸,由于“洗气”都是“长进短出”,故实验装置的连接顺序是cdab。故选C
②实验室常用澄清石灰水检验二氧化碳的存在,是因为二氧化碳能与澄清石灰水反应,生成碳酸钙沉淀和水,故反应的化学方程式为CO2+Ca(OH)2 = CaCO3↓+H2O。
考点:常用气体的发生装置和收集装置与选取方法,实验室制取氧气的反应原理,实验室制取二氧化碳的反应原理,书写化学方程式,常见气体的检验与除杂方法,物质的鉴别、推断
点评:熟记氧气和二氧化碳的实验室制法、原理和操作注意事项,是解题的关键;本题考查的重点之一是常用气体的发生装置和收集装置的选取方法,要学会根据反应物的状态和反应的条件选择发生装置,根据制取气体的溶解性和密度的大小选择收集气体的方法;此外,对于常见气体的检验,要依据气体的性质进行解答,特别需要注意的是,当检验某气体和水时需要先检验水的存在,而要除去某气体和水时需要后除水。