题目内容
如图是某同学配制60g质量分数为22%的氯化钠溶液的操作过程示意图.试回答:

(1)配制溶液的正确操作步骤是
(2)该实验中应称氯化钠的质量是
(3)量取水时所用量筒的规格应为

(1)配制溶液的正确操作步骤是
计算、称量、量取、溶解、装瓶存放
计算、称量、量取、溶解、装瓶存放
.(2)该实验中应称氯化钠的质量是
13.2
13.2
g,A操作中实际称量结果为12.8
12.8
g(1g以下用游码).(3)量取水时所用量筒的规格应为
50
50
mL(10或50或100).分析:(1)根据配制溶质质量分数一定的溶液的基本步骤考虑;
(2)溶质质量=溶液质量×溶质质量分数,根据左码右物称量时物质实际质量的计算方法考虑;
(3)溶剂质量=溶液质量-溶质质量,再根据量筒的选取方法考虑.
(2)溶质质量=溶液质量×溶质质量分数,根据左码右物称量时物质实际质量的计算方法考虑;
(3)溶剂质量=溶液质量-溶质质量,再根据量筒的选取方法考虑.
解答:解:(1)配制溶质质量分数一定的溶液的基本步骤:计算、称量、量取、溶解、装瓶存放;
(2)氯化钠质量:60g×22%=13.2g,如果左码右物称量时,物体的实际质量=砝码的质量-游码的质量=13g-0.2g=12.8g;
(3)需水的体积是:(60g-13.2g)×1.0g/mL=46.8mL,在选取量筒量程时要选取比46.8大且最接近的,所以选取50mL的量筒.
故答案为:(1)计算、称量、量取、溶解、装瓶存放;(2)13.2;12.8;(3)50.
(2)氯化钠质量:60g×22%=13.2g,如果左码右物称量时,物体的实际质量=砝码的质量-游码的质量=13g-0.2g=12.8g;
(3)需水的体积是:(60g-13.2g)×1.0g/mL=46.8mL,在选取量筒量程时要选取比46.8大且最接近的,所以选取50mL的量筒.
故答案为:(1)计算、称量、量取、溶解、装瓶存放;(2)13.2;12.8;(3)50.
点评:通过回答本题知道了配制溶质质量分数一定的溶液的基本步骤,掌握了量筒的选取方法,溶质的计算方法.

练习册系列答案
相关题目
| |||||||||||||||||||||||||||||||||



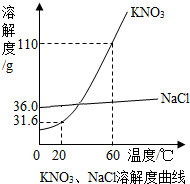 KNO3、NaCl溶液在生产、生活中起着十分重要的作用.如图是它们的溶解度曲线,下表是它们在不同温度时的溶解度.
KNO3、NaCl溶液在生产、生活中起着十分重要的作用.如图是它们的溶解度曲线,下表是它们在不同温度时的溶解度.





