题目内容
某工厂需要100 kg氧气做原料.若用电解水的方法制取这些氧气,求:
(1)需要消耗水的质量是多少?
(2)同时可以得到氢气的质量是多少(用两种不同方法解答)?
解:设需要消耗水的质量为x,生成的氢气质量为y
2H2O 2H2↑+O2↑
2H2↑+O2↑
36 4 32
x y 100kg
∴ =
= ,
,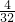 =
=
解之得:x=112.5kg,y=12.5kg.
或根据质量守恒求解:
y=112.5kg-100kg=12.5kg.
或根据H2O中H、O质量比求解:
1:8=y:100kg
解得:y=12.5kg.
答:需要消耗水的质量是112.5kg,同时可以得到氢气的质量是12.5kg.
分析:欲正确解答本题,需根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出所需物质的质量.也可根据质量守恒定律计算,或根据H2O中H、O质量比求解.
点评:本题主要考查学生运用化学方程式进行计算的能力.
2H2O
 2H2↑+O2↑
2H2↑+O2↑36 4 32
x y 100kg
∴
 =
= ,
,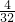 =
=
解之得:x=112.5kg,y=12.5kg.
或根据质量守恒求解:
y=112.5kg-100kg=12.5kg.
或根据H2O中H、O质量比求解:
1:8=y:100kg
解得:y=12.5kg.
答:需要消耗水的质量是112.5kg,同时可以得到氢气的质量是12.5kg.
分析:欲正确解答本题,需根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出所需物质的质量.也可根据质量守恒定律计算,或根据H2O中H、O质量比求解.
点评:本题主要考查学生运用化学方程式进行计算的能力.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
某密闭容器中盛有一定质量的水蒸气、二氧化碳、氧气和一种未知物质R,在一定条件下充分反应,测得反应前后各物质的质量如下表所示,则下列说法错误的是
| 物 质 | 氧气 | 二氧化碳 | 水蒸气 | 一氧化碳 | R |
| 反应前质量/g | 80 | 2 | 1 | 0 | 46 |
| 反应后质量/g | 0 | 46 | 55 | 28 | x |
- A.根据质量守恒定律可知,x值应为0
- B.反应后的生成物为二氧化碳、一氧化碳和水
- C.增加氧气的量可减少生成物的种类
- D.物质R中一定含碳、氢元素,可能含氧元素
将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:
| 物质 | a | b | c | d |
| 反应前质量(g) | 6 | 3 | 4.0 | 0.5 |
| 反应后质量(g) | 待测 | 1.4 | 7.2 | 0.5 |
- A.d可能是催化剂
- B.该反应为分解反应
- C.反应后a的质量为4.4g
- D.若反应中a与b的化学计量数之比为2:1,则物质a与物质b的相对分子质量之比为1:2





 日本地震引发的核电站泄漏引起了全球人们的恐慌,核电站泄漏物质中包含放射性元素碘-131.如图是元素周期表中碘元素的某些信息,下列说法中不正确的是
日本地震引发的核电站泄漏引起了全球人们的恐慌,核电站泄漏物质中包含放射性元素碘-131.如图是元素周期表中碘元素的某些信息,下列说法中不正确的是