题目内容
已知铁与稀硫酸(H2SO4)反应生成硫酸亚铁(FeSO4)和氢气.现将21g铁粉与足量的稀硫酸反应.计算:
(1)生成的氢气和硫酸亚铁各多少克?
(2)生成的氢气在标准状况下的体积是多少升?(氢气的密度是0.09g/L)
解析:
|
答:(1)生成H2 0.75g,FeSO4 57g;(2)生成的H2在标准状况下的体积为8.33L. 解:设21g铁粉与足量稀硫酸反应后可生成H2的质量为x,生成FeSO4的质量为y Fe+H2SO4=FeSO4+H2↑ 56 152 2 21g y x 氢气的体积= 思路分析:这是根据化学方程式,由反应物的质量求生成物质量的计算题.先写出Fe与H2SO4反应的化学方程式,找出有关物质的关系量,用已知量21g铁求出氢气和硫酸亚铁的质量,再利用气体体积= |

【探究一】在室温条件下进行右图所示实验。
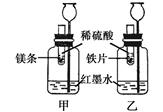
已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量和等质量分数的稀硫酸,甲中反应方程式为 。
(1)若比较镁和铁的金属活动性,观察到的现象是 ;
(2)若比较相同时间内镁、铁与稀硫酸反应放出热量的多少,长颈漏斗中的现象是 ;
(3)若实验所用的金属均过量,则甲装置中产生的H2的质量 (填“大于”、“小于”或“等于”)乙装置中产生的H2质量。
【探究二】在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生。下列判断正确的是 。
| A.滤出的固体中一定含有铜 |
| B.滤出的固体可能含有铁和镁 |
| C.滤液中可能含有硫酸铜 |
| D.滤液中一定含有硫酸镁和硫酸亚铁 |
某化学活动小组探究金属的反应规律。
【探究一】在室温条件下进行右图所示实验。
已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量和等质量分数的稀硫酸,甲中反应方程式为 。
(1)若比较镁和铁的金属活动性,观察到的现象是 ;
(2)若比较相同时间内镁、铁与稀硫酸反应放出热量的多少,长颈漏斗中的现象是 ;
(3)若实验所用的金属均过量,则甲装置中产生的H2的质量 (填“大于”、“小于”或“等于”)乙装置中产生的H2质量。
【探究二】在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生。下列判断正确的是 。
| A.滤出的固体中一定含有铜 |
| B.滤出的固体可能含有铁和镁 |
| C.滤液中可能含有硫酸铜 |
| D.滤液中一定含有硫酸镁和硫酸亚铁 |


 D.滤液中一定含有硫酸镁和硫酸亚铁
D.滤液中一定含有硫酸镁和硫酸亚铁