题目内容
某温度下,某实验小组在用粗锌(杂质难溶于水且与稀硫酸不反应)与200g稀硫酸反应时,实验数据如下表所示.
| 实验 序号 | 粗锌的质量/g | 稀硫酸的质量/g | 生成气体的质量/g | 反应后溶液过滤,所得 固体烘干后的质量/g |
| 实验1 | 15 | 200 | 0.4 | 2 |
| 实验2 | 30 | 200 | 0.8 | 4 |
| 实验3 | 45 | 200 | 1.0 | 17.5 |
(2)计算:实验3反应后溶液中硫酸锌的质量.
(2)设生成硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
161 2
y 1.0g
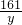 =
=
y=8.05g
答:反应后溶液中硫酸锌的质量是8.05g.
故答案为:(1)3;(2)8.05g.
分析:(1)由于铜与稀硫酸不反应,故粗锌与稀硫酸的反应,为锌与稀硫酸的反应;根据实验1产生氢气的质量可知:加入15g粗锌生成0.4g氢气,则每增加15g粗锌应增加0.4g氢气,从实验3数据可知,生成氢气的质量应该是1.2g,却是1.0g,说明稀硫酸完全反应,实验3中锌过量;
(2)根据生成氢气的质量可以计算出生成的硫酸锌的质量.
点评:本题考查了学生依据化学反应原理和图表数据分析解答问题的能力,要求学生有较强的数据分析能力.

某温度下,某实验小组在用粗锌(杂质难溶于水且与稀硫酸不反应)与200 g稀硫酸反应时,实验数据如下表所示。
| 实验 序号 | 粗锌的质量/g | 稀硫酸的质量/g | 生成气体的质量/g | 反应后溶液过滤,所得 固体烘干后的质量/g |
| 实验1 | 15 | 200 | 0.4 | 2 |
| 实验2 | 30 | 200 | 0.8 | 4 |
| 实验3 | 45 | 200 | 1.0 | 17.5 |
(2)计算:实验3反应后溶液中硫酸锌的质量。
某温度下,某实验小组在用粗锌(杂质难溶于水且与稀硫酸不反应)与200 g稀硫酸反应时,实验数据如下表所示。
|
实验 序号 |
粗锌的质量/g |
稀硫酸的质量/g |
生成气体的质量/g |
反应后溶液过滤,所得 固体烘干后的质量/g |
|
实验1 |
15 |
200 |
0.4 |
2 |
|
实验2 |
30 |
200 |
0.8 |
4 |
|
实验3 |
45 |
200 |
1.0 |
17.5 |
(1)上述实验中,粗锌中的锌有剩余的是 (填实验序号)。
(2)计算:实验3反应后溶液中硫酸锌的质量。
在日常生活中,有这样的说法,“肥皂水是碱性的,洗衣粉溶液是酸性的”。这种说法正确吗?肥皂和洗衣粉混用会降低去污效果吗?某科学兴趣小组对此进行了探究,实验过程如下:
①取三个塑料杯,分别编为甲、乙、丙,在甲杯中加入5克洗衣粉、乙杯中加入5克肥皂、丙杯中加入2.5克洗衣粉和2.5克肥皂混合。
②在三个塑料杯中,分别加入相同温度、相同质量的水,充分搅拌使之完全溶解,并测出溶液pH。
③在相同温度下,将三块大小、油污程度均相同的白棉布分别放入三杯溶液中浸泡10分钟后,取出观察,实验结果记录如下:
|
|
甲 |
乙 |
丙 |
|
洗涤前洗涤剂溶液pH |
10 |
8 |
9 |
|
去污效果 |
基本去除油污 |
基本去除油污 |
基本去除油污 |
换另一种品牌洗衣粉和肥皂做同样实验,实验结果记录如下:
|
|
甲 |
乙 |
丙 |
|
洗涤前洗涤剂溶液pH |
8 |
9 |
9 |
|
去污效果 |
完全去除油污 |
完全去除油污 |
完全去除油污 |
根据上述实验,回答下列问题:
(1)“肥皂水是碱性的,洗衣粉溶液是酸性的”,这种说法正确吗? (选填“正确”或“不正确”)。
(2)将肥皂和洗衣粉混合使用会降低去污效果吗? (选填“会”或“不会”)。
(3)为什么要换另一种品牌洗衣粉和肥皂重复同样的实验?