题目内容
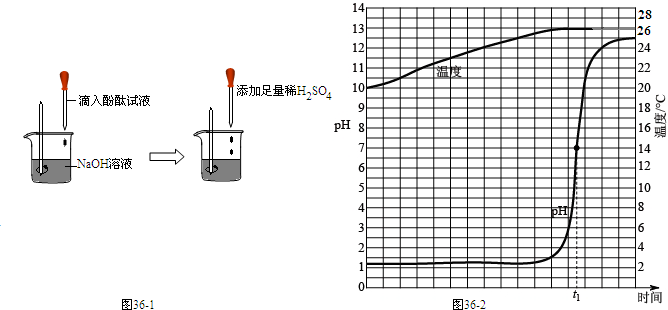
在pH=3的无色水溶液中可能大量存在的离子组是( )
| A.K+、Cu2+、Cl- | B.K+、SO42-、Ba2+ |
| C.Cl-、Mg2+、Na+ | D.Cl-、CO32-、Na+ |
pH为3的水溶液显酸性,水溶液中含有大量的H+.
A、三者之间不反应,且能在酸性溶液中共存,但Cu2+的水溶液显蓝色,故选项错误.
B、SO42-、Ba2+在溶液中能结合生成硫酸钡沉淀,不能大量共存,故选项错误.
C、三者之间不反应,能在酸性溶液中共存,且不存在有色离子,故选项正确.
D、CO32-与酸性溶液中的H+两种离子能结合成水和二氧化碳,不能大量共存,故选项错误.
故选C.
A、三者之间不反应,且能在酸性溶液中共存,但Cu2+的水溶液显蓝色,故选项错误.
B、SO42-、Ba2+在溶液中能结合生成硫酸钡沉淀,不能大量共存,故选项错误.
C、三者之间不反应,能在酸性溶液中共存,且不存在有色离子,故选项正确.
D、CO32-与酸性溶液中的H+两种离子能结合成水和二氧化碳,不能大量共存,故选项错误.
故选C.

练习册系列答案
相关题目
下图甲~己是实验室制取某些常见气体的装置图.
(1)仪器a、b的名称是a 、b ;
(2)甲装置可用于实验室制取O2,写出该反应的化学方程式 ;
(3)以下方案是对排水法与排空气法收集O2的比较(使用体积相同的集气瓶收集O2)
(4)装置乙和丙都能用于实验室制取CO2,丙相对于乙在操作方面的优点为 ;
(5)使用丁装置制取气体时,对反应物和反应条件的要求是 ;
(6)用块状的石灰石与过量稀盐酸反应制取CO2,若参加反应的碳酸钙的物质的量为0.1mol,请回答:
Ⅰ.反应生成CO2的物质的量为 (根据化学方程式列式计算);
Ⅱ.待块状石灰石与过量稀盐酸反应至不再冒气泡后,过滤反应后的混合物,并向滤液中逐滴滴入碳酸钠溶液,并用pH数字探测仪连续监测,得到如下曲线:

(已知CaCl2溶液呈中性)
①写出AB段反应的实验现象 ;
②BC段的反应生成了白色沉淀,写出该反应的化学方程式 ;
③DE段所对应溶液中的溶质有NaCl和 .

(1)仪器a、b的名称是a
(2)甲装置可用于实验室制取O2,写出该反应的化学方程式
(3)以下方案是对排水法与排空气法收集O2的比较(使用体积相同的集气瓶收集O2)
| 比较项目 | 向上排空气法 | 排水集气法 | 结论 |
| 方法可行性 | O2的密度比空气 |
O2难溶于水且不与水反应 | 两种方法均可行 |
| 收集的过程 | “验满”分析:即便用带火星的木条移近集气瓶口,木条复燃也难以证明空气被排尽,因气体无色,集满与否较难确定. | 集满O2的现象是 |
排水法收集O2更易于观察何时集满 |
| 收集O2的纯度 | 分别用排水法和向上排空气法收集两瓶氧气(A和B),放入两支相同的蜡烛.可观察到B瓶内的蜡烛熄灭较早 |
结论 | |
(5)使用丁装置制取气体时,对反应物和反应条件的要求是
(6)用块状的石灰石与过量稀盐酸反应制取CO2,若参加反应的碳酸钙的物质的量为0.1mol,请回答:
Ⅰ.反应生成CO2的物质的量为
Ⅱ.待块状石灰石与过量稀盐酸反应至不再冒气泡后,过滤反应后的混合物,并向滤液中逐滴滴入碳酸钠溶液,并用pH数字探测仪连续监测,得到如下曲线:

(已知CaCl2溶液呈中性)
①写出AB段反应的实验现象
②BC段的反应生成了白色沉淀,写出该反应的化学方程式
③DE段所对应溶液中的溶质有NaCl和
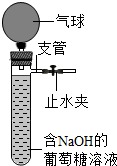 (2013?下城区二模)实验老师发现,他一周前配好的无色透明的葡萄糖溶液变成了黄色,他对产生此现象的原因十分好奇,进行了如下实验探究.
(2013?下城区二模)实验老师发现,他一周前配好的无色透明的葡萄糖溶液变成了黄色,他对产生此现象的原因十分好奇,进行了如下实验探究. 一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.
一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示.