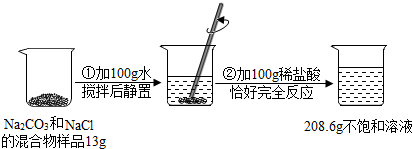
题目内容
请根据下图所示的实验过程和提供的数据,计算不饱和溶液Ⅱ中溶质的质量分数.


分析:依据质量守恒定律反应前后物质的总质量相等,计算生成二氧化碳的质量,再根据已知的二氧化碳质量代入化学方程式求得参加反应的碳酸钙和生成的氯化钙的质量,最后可求得反应后溶液中溶质的质量分数.
解答:解:mCO2=15.55g+100g+146g-257.15g=4.4g
设混合物样品中CaCO3的质量为x,CaCO3和HCl 反应生成CaCl2的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
=
=
x=10g y=11.1g
则原混合物中CaCl2的质量=15.55g-10=5.55g
不饱和溶液Ⅱ中溶质CaCl2的质量分数
×100%=3.33%
答:不饱和溶液Ⅱ中溶质CaCl2的质量分数为3.33%.
设混合物样品中CaCO3的质量为x,CaCO3和HCl 反应生成CaCl2的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
| 100 |
| x |
| 44 |
| 4.4g |
| 111 |
| y |
| 44 |
| 4.4g |
x=10g y=11.1g
则原混合物中CaCl2的质量=15.55g-10=5.55g
不饱和溶液Ⅱ中溶质CaCl2的质量分数
| 5.55g+11.1g |
| 500g |
答:不饱和溶液Ⅱ中溶质CaCl2的质量分数为3.33%.
点评:解此题的关键是根据图示测得的相关数据及质量守恒定律计算出隐藏的已知量---生成的二氧化碳质量;进而按化学方程式的解题格式解答即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目