题目内容
在一密闭容器中盛有20g氢气与氧气的混合气体,经点燃后,容器中余下气体的质量为2g,求原气体中氢气和氧气的质量?分析:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.故生成水的质量为20g-2g=18g;
①假设氢气完全反应,利用化学方程式和水的质量,列出比例式,就可计算出混合气体中氢气的质量,然后根据“混合气体质量-氢气质量”求出氧气质量;
②假设氧气完全反应,利用化学方程式和水的质量,列出比例式,就可计算出混合气体中氧气的质量,然后根据“混合气体质量-氧气质量”计算出氢气的质量.
①假设氢气完全反应,利用化学方程式和水的质量,列出比例式,就可计算出混合气体中氢气的质量,然后根据“混合气体质量-氢气质量”求出氧气质量;
②假设氧气完全反应,利用化学方程式和水的质量,列出比例式,就可计算出混合气体中氧气的质量,然后根据“混合气体质量-氧气质量”计算出氢气的质量.
解答:解:根据质量守恒定律,生成水的质量为20g-2g=18g;
①设完全反应的氢气质量为x,
2H2+O2
2H2O
4 36
x 18g
∴
=
∴x=
=2g,
则混合气体中氧气的质量=20g-2g=18g;
②设氧气完全反应的质量为y,
2H2+O2
2H2O
32 36
y 18g
∴
=
∴y=
=16g;
则混合气体中氢气的质量=20g-16g=4g.
答:①原气体中氢气质量为2g,氧气的质量为18g;
②原气体中氢气质量为4g,氧气的质量为16g.
①设完全反应的氢气质量为x,
2H2+O2
| ||
4 36
x 18g
∴
| 4 |
| 36 |
| x |
| 18g |
∴x=
| 18g×4 |
| 36 |
则混合气体中氧气的质量=20g-2g=18g;
②设氧气完全反应的质量为y,
2H2+O2
| ||
32 36
y 18g
∴
| 32 |
| 36 |
| y |
| 18g |
∴y=
| 18g×32 |
| 36 |
则混合气体中氢气的质量=20g-16g=4g.
答:①原气体中氢气质量为2g,氧气的质量为18g;
②原气体中氢气质量为4g,氧气的质量为16g.
点评:本题主要考查学生利用化学方程式和质量守恒定律进行计算的能力.学生需全面分析反应的情况,才能正确解答.

练习册系列答案
相关题目
(1)在实验室制取氧气和二氧化碳的装置中,可用同一个制取装置,写出此种制取氧气的化学方程式______为______反应类型.
(2)在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应,测得反应前后各物质质量如下表
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 4 | 1 | 42 | 10 |
| 反应前质量/g | 待测 | 20 | 6 | 31 |
A.该变化的基本反应类型一定是置换反应
B.参加反应的甲、丙的质量比为1:9
C.乙、丁的相对分子质量比一定为10:9
D.甲反应后的质量为8g
(3)配平□FexOy+□CO═□Fe+□CO2 (填化学式前的计量数).
(4)在验证质量守恒定律的实验中,将打磨的铁钉放入到盛有硫酸铜的溶液中,过一段时间后,我们能观察到的现象是______其反应化学方程式为______.
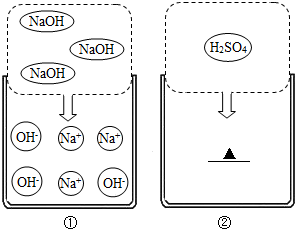
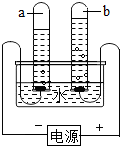
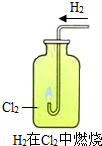



 2HCl.
2HCl.