题目内容
12.纳米材料颗粒尺寸为l纳米~10纳米,其材料能表现出许多特殊的性质.在高温条件下,用H2能与FeCl2反应,可生成“纳米铁”,反应原理为:FeCl2+H2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl.该反应类型属于( )| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
分析 根据置换反应的特点进行解答.
解答 解:置换反应是一种单质与一种化合物反应生成另一种单质和另一种化合物的反应,故FeCl2+H2$\frac{\underline{\;高温\;}}{\;}$Fe+2HCl属于置换反应;
故选C
点评 本题考查了反应的类型判定,题目较易.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
3.下列实验操作,主要不是从安全因素考虑的是( )
| A. | 急于加药品时,也不可用手直接抓取 | |
| B. | 禁止向燃着的酒精灯里添加酒精 | |
| C. | 给试管里的液体加热时,液体的量不超过试管容积的三分之一,不可让试管口对着自己和旁人 | |
| D. | 用量筒量取液体时,视线应与量筒内液体凹液面的最低处保持水平 |
17.下列电离方程式书写正确的是( )
| A. | H2SO4═H++SO42- | B. | Ba(OH)2═Ba2++OH- | ||
| C. | Cu(NO3)2═Cu2++2NO3- | D. | CaCl2═Ca2++Cl2- |
1.今有氢气和氧气的混合气体共4克,在密闭的容器中使其充分反应后,生成的水是1.8克,则原混合气的组成可能是( )
| A. | 1克氢气,3克氧气 | B. | 0.2克氢气,3.8克氧气 | ||
| C. | 2克氢气,2克氧气 | D. | 0.8克氢气,1克氧气 |

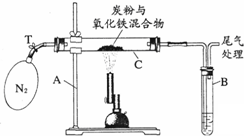 某化学兴趣小组的学生研究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分.探究过程如下:
某化学兴趣小组的学生研究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分.探究过程如下: 如图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答:
如图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答: