题目内容
要使Fe2O3和Fe3O4含有相同质量的铁元素,则Fe2O3和Fe3O4质量比是( )A.3:2
B.1:1
C.30:29
D.29:42
【答案】分析:根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,结合题意进行分析解答.
解答:解:设Fe2O3和Fe3O4的质量分别为x、y,由题意:
x× ×100%=y×
×100%=y× ×100%,(160、232分别为Fe2O3和Fe3O4的相对分子质量)
×100%,(160、232分别为Fe2O3和Fe3O4的相对分子质量)
x:y=30:29.
或要使Fe2O3和Fe3O4含有相同质量的铁元素,则铁原子的个数应相等,3Fe2O3和2Fe3O4中铁原子个数相等,则Fe2O3和Fe3O4质量比(2×160):(3×232)=30:29.
故选C.
点评:本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.
解答:解:设Fe2O3和Fe3O4的质量分别为x、y,由题意:
x×
 ×100%=y×
×100%=y× ×100%,(160、232分别为Fe2O3和Fe3O4的相对分子质量)
×100%,(160、232分别为Fe2O3和Fe3O4的相对分子质量)x:y=30:29.
或要使Fe2O3和Fe3O4含有相同质量的铁元素,则铁原子的个数应相等,3Fe2O3和2Fe3O4中铁原子个数相等,则Fe2O3和Fe3O4质量比(2×160):(3×232)=30:29.
故选C.
点评:本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
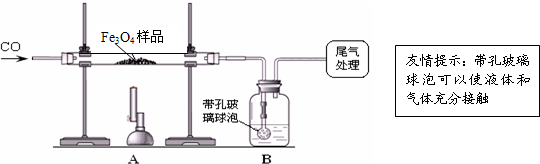
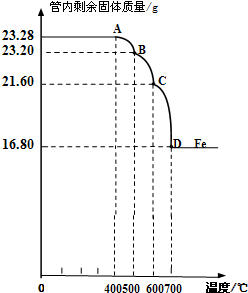 质量差会偏小而影响计算、分析,你认为他们的理由是
质量差会偏小而影响计算、分析,你认为他们的理由是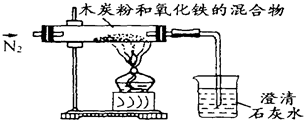 已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C
已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C