题目内容
15.海水是一种重要的自然资源,以下是某市对海水资源的部分利用(1)从海水中获得氯化钠,将海水进行蒸发结晶可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,有如下操作①溶解;②加过量的Na2CO3溶液;③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量的NaOH溶液;⑥蒸发结晶;⑦过滤.正确的操作顺序是①③⑤②⑦④⑥或①⑤③②⑦④⑥.
(2)上述步骤中的⑤加入过量的NaOH溶液的目的是除去粗盐中的镁离子.
分析 (1)根据食盐的溶解度受温度影响变化不大,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答.
(2)根据氢氧化钠溶液能与镁离子反应生成氢氧化镁沉淀,进行分析解答.
解答 解:(1)食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来,利用的是蒸发溶剂结晶法.
镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可溶液以将镁离子沉淀;硫酸根离子用钡离子沉淀,加入过量的氯化钡溶液可以将硫酸根离子沉淀;至于先除镁离子,还是先除硫酸根离子都可以;钙离子用碳酸根离子沉淀,除钙离子加入过量的碳酸钠溶液转化为沉淀,但是加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡;完全反应后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:①③⑤②⑦④⑥或①⑤③②⑦④⑥.
(2)氢氧化钠溶液能与镁离子反应生成氢氧化镁沉淀,步骤中的⑤加入过量的NaOH溶液的目的是除去粗盐中的镁离子.
故答案为:(1)蒸发结晶;①③⑤②⑦④⑥或①⑤③②⑦④⑥;(2)除去粗盐中的镁离子.
点评 本题难度较大,考查了粗盐提纯中离子的除杂,除去多种杂质离子时,要考虑除杂的顺序、后面加入的试剂要能除去前面加入的过量的试剂.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列实验方法能达到实验目的是( )
| A. | 除去CaCl2溶液中稀盐酸时先加入过量的CaCO3再过滤 | |
| B. | 用分液漏斗分离水与乙醇的混合物 | |
| C. | 将一段镍铬合金丝接入一简单电路使小灯泡发光,能说明导体的电阻与材料有关 | |
| D. | 将不同小车分别从斜面的不同高度由静止开始下滑,撞击水平面上的同一木块,能说明动能的大小与质量有关 |
20.下列关于水和空气的说法不正确的是( )
| A. | 空气中分离出的氮气化学性质不活泼,可作食品保护气 | |
| B. | 为了防止水体污染,要禁止使用农药和化肥 | |
| C. | 自来水厂用活性炭吸附属于物理变化 | |
| D. | 可用肥皂水来区分硬水和软水 |
4.下列物质的用途不正确的是( )
| A. |  石墨做电刷 | B. |  树木涂石灰浆防止冻伤 | ||
| C. |  用烧碱泡发鱿鱼 | D. |  硫酸--铅蓄电池 |
 中考倒计时活动需要用到气球来布置班级,小李认为可以利用所学的化学反应来快速的吹气球,他设计了如图所示的装置,打开分液漏斗,使其中的无色液体与试管中的固体接触反应,可观察到气球胀大现象,请分别写出一个符合图中现象和下列要求的化学方程式:
中考倒计时活动需要用到气球来布置班级,小李认为可以利用所学的化学反应来快速的吹气球,他设计了如图所示的装置,打开分液漏斗,使其中的无色液体与试管中的固体接触反应,可观察到气球胀大现象,请分别写出一个符合图中现象和下列要求的化学方程式: (1)x表示核内质子数,该粒子有3个电子层,y与粒子的化学性质关系非常密切.
(1)x表示核内质子数,该粒子有3个电子层,y与粒子的化学性质关系非常密切.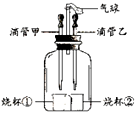 某化学兴趣小组设计如图所示装置,可以用来完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点
某化学兴趣小组设计如图所示装置,可以用来完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点 如图甲、乙所示是氧元素在元素周期表中的信息和该元素形成的某种微粒的结构示意图,根据图示回答:
如图甲、乙所示是氧元素在元素周期表中的信息和该元素形成的某种微粒的结构示意图,根据图示回答: