题目内容
2.在化学反应2A+B═C+D中,8g A和16g B恰好完全反应生成10g C,若12g A参加反应,生成D的质量是( )| A. | 20g | B. | 24g | C. | 15g | D. | 21g |
分析 根据质量守恒定律,在化学反应中,参加反应的各物质的质量总和等于反应后生成各物质的质量总和,可以求出生成D的质量.
解答 解:根据质量守恒定律可以知道8gA和16gB恰好完全反应生成10gC,则生成D的质量为:8g+16g-10g=14g;
设第二次生成D的质量为x,
A+B═C+D
8g 14g
12g x
$\frac{8g}{14g}=\frac{12g}{x}$,解得:x=21g.
故选:D.
点评 本题主要考查学生运用质量守恒定律进行推断的能力,需认真分析,找出质量关系,就可以求解.

练习册系列答案
相关题目
12.下列属于纯净物的是( )
| A. | 碳素墨水 | B. | 生理盐水 | C. | 冰水 | D. | 葡萄糖水 |
17.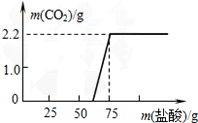 端午阳节后,小丽带着快乐的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH固体,由此,激发了她的探究欲望
端午阳节后,小丽带着快乐的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH固体,由此,激发了她的探究欲望
【提出问题】这瓶NaOH固体一定变质了,其变质程度如何呢?
【提出猜想】小丽的猜想:NaOH固体全部变质
你的猜想:NaOH固体部分变质
【实验和推断】取少量该溶液于试管中,加入过量的氯化钙溶液,静置后,在上层清液中,滴加2~3滴无色酚酞,观察现象.经过实验证明你的猜想正确,则实验中观察到的实验现象是产生白色沉淀,酚酞试液变红.
【定量研究】通过上述实验证明氢氧化钠固体是部分变质,那么变质程度又是怎样的呢,小丽同学又进行了探究:先称取13.3g的NaOH样品,配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量.从而进一步确定样品中NaOH的变质程度.
(1)实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示.填写下表:(计算结果保留小数点后一位)
(2)求实验过程中与NaOH反应所用盐酸的质量.(写出计算过程)
(3)根据“与NaOH反应所用盐酸的质量”,对照图象,你发现了什么问题?
 端午阳节后,小丽带着快乐的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH固体,由此,激发了她的探究欲望
端午阳节后,小丽带着快乐的心情返回学校.当她来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH固体,由此,激发了她的探究欲望【提出问题】这瓶NaOH固体一定变质了,其变质程度如何呢?
【提出猜想】小丽的猜想:NaOH固体全部变质
你的猜想:NaOH固体部分变质
【实验和推断】取少量该溶液于试管中,加入过量的氯化钙溶液,静置后,在上层清液中,滴加2~3滴无色酚酞,观察现象.经过实验证明你的猜想正确,则实验中观察到的实验现象是产生白色沉淀,酚酞试液变红.
【定量研究】通过上述实验证明氢氧化钠固体是部分变质,那么变质程度又是怎样的呢,小丽同学又进行了探究:先称取13.3g的NaOH样品,配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量.从而进一步确定样品中NaOH的变质程度.
(1)实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示.填写下表:(计算结果保留小数点后一位)
| Na2CO3的质量/g | 5.3 |
| 变质的NaOH的质量/g | 4.0 |
| NaOH的变质程度(用质量分数表示) | 33.3% |
(3)根据“与NaOH反应所用盐酸的质量”,对照图象,你发现了什么问题?
 如图是给病人输液用的氯化钠注射液的标签,请根据该标签提供的信息回答:
如图是给病人输液用的氯化钠注射液的标签,请根据该标签提供的信息回答: