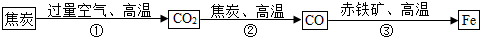题目内容
向5支分别盛有等质量的镁条、铁片、锌片、铝片、铜片的试管中,加入足量的稀硫酸:不能产生气体的是________,产生气体速率最大的是________,金属完全反应后,生成氢气最多的是________.
答案:
解析:
提示:
解析:
|
分清金属与酸反应速率的大小与生成气体质量(或体积)多少的区别,反应速率的大小取决于金属活动性的强弱,(金属质量相同、酸足量时)生成气体的多少取决于金属的相对原子质量.根据金属活动性顺序,题中5种金属的活动性由强到弱的顺序是: Mg>Al>Zn>Fe>(H)>Cu 通过实验也可知,只有排在H前的金属,才能从稀硫酸中置换出氢气,且金属越活泼,与酸反应越剧烈,产生气体速率越大.所以5种金属中,不能产生气体的是铜,产生气体速率最大的是镁.哪种金属完全反应后生成的气体最多,要通过计算来分析、判断.首先根据化学方程式建立金属与气体的质量关系:
可见,质量相同的镁、铝、锌、铁完全反应时,铝生成的氢气最多. |
提示:
|
本题主要检测:①金属活动性顺序的应用;②金属与酸反应的有关计算. |

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目