题目内容
(2005?西城区二模)如图,实验室常用一定质量分数的过氧化氢无色溶液(溶质为H2O2),在二氧化锰作催化剂的条件下反应来制取氧气
(2H2O2
2H2O+O2↑).某同学实验前测得过氧化氢溶液42.5g,加入1g MnO2,完全反应后测得反应容器中剩余物质量为41.9g.
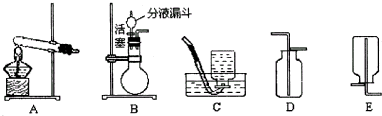
请回答:
(1)实验室用分解双氧水的方法制取氧气时,选择的发生装置应为
(2)收集装置应选择
(3)反应后放出氧气的质量是
(2H2O2
| ||

请回答:
(1)实验室用分解双氧水的方法制取氧气时,选择的发生装置应为
B
B
.(2)收集装置应选择
C或D
C或D
,原因是氧气不易溶于水且比空气的密度大
氧气不易溶于水且比空气的密度大
.(3)反应后放出氧气的质量是
1.6g
1.6g
,所用过氧化氢溶液中溶质的质量分数为8%
8%
.分析:根据双氧水分解的反应原理及氧气的密度和溶解性确定发生和收集装置,并根据质量守恒定律判断氧气的质量,依据方程式和溶质的质量分数计算过氧化氢溶液中溶质的质量分数.
解答:解:(1)过氧化氢无色溶液(溶质为H2O2),在二氧化锰作催化剂的条件下反应来制取氧气,不需加热,属于“固液常温型”,故选择B;
故答案为:B;
(2)氧气不易溶于水且比空气的密度大所以可用排水法或向上排空气法收集;
故答案为:C或D 氧气不易溶于水且比空气的密度大:
(3)根据质量守恒定律可知:放出氧气的质量是42.5g+1g-41.9g=1.6g
设过氧化氢溶液中溶质的质量是X
2H2O2
2H2O+O2↑
68 32
X 1.6g
=
X=3.4g
所以过氧化氢溶液中中溶质的质量分数为:
×100%=8%
故答案为:8%
故答案为:B;
(2)氧气不易溶于水且比空气的密度大所以可用排水法或向上排空气法收集;
故答案为:C或D 氧气不易溶于水且比空气的密度大:
(3)根据质量守恒定律可知:放出氧气的质量是42.5g+1g-41.9g=1.6g
设过氧化氢溶液中溶质的质量是X
2H2O2
| ||
68 32
X 1.6g
| 68 |
| X |
| 32 |
| 1.6g |
X=3.4g
所以过氧化氢溶液中中溶质的质量分数为:
| 3.4g |
| 42.5g |
故答案为:8%
点评:本题考查了实验室依据双氧水制取氧气的反应原理判断制取氧气的发生装置,依据气体的密度和溶解性判断收集装置,并进行相关计算,难度不大,掌握方法即可正确解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目