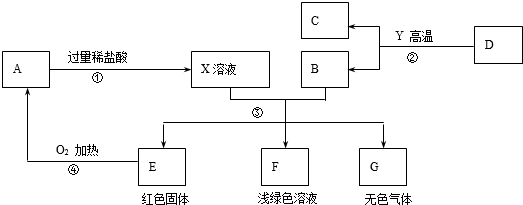
题目内容
8.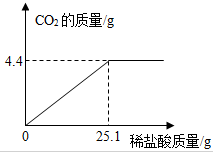 小苏打(主要成分是碳酸氢钠)是一种优良的膨松剂(发面剂),小思同学为测定小苏打中碳酸氢钠的质量分数进行如下实验.取小苏打样品9.3g(假设该样品中只含有氯化钠一种杂质),逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,求(计算结果用百分数表示,保留到0.1%,NaHCO3+HCl═NaCl+CO2↑+H2O):
小苏打(主要成分是碳酸氢钠)是一种优良的膨松剂(发面剂),小思同学为测定小苏打中碳酸氢钠的质量分数进行如下实验.取小苏打样品9.3g(假设该样品中只含有氯化钠一种杂质),逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,求(计算结果用百分数表示,保留到0.1%,NaHCO3+HCl═NaCl+CO2↑+H2O):(1)样品中碳酸氢钠的质量分数.
(2)稀盐酸的质量分数.
(3)恰好完全反应时,所得溶液中溶质的质量分数.
分析 碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;由生成CO2气体的质量与滴加稀盐酸的质量关系图,取小苏打样品10.0克,逐滴加入稀盐酸,最终生成二氧化碳气体的质量为4.4g,据此由反应的化学方程式计算出小苏打样品中碳酸氢钠的质量、所得溶液中溶质的质量分数即可.
解答 解:(1)由生成CO2气体的质量与滴加稀盐酸的质量关系图,小苏打样品10.0克,逐滴加入稀盐酸,最终生成二氧化碳气体的质量为4.4g.
设小苏打样品中碳酸氢钠的质量为x,所用稀盐酸中溶质质量为y,生成氯化钠的质量为z
NaHCO3+HCl═NaCl+CO2↑+H2O
84 36.5 58.5 44
x y z 4.4g
$\frac{84}{x}=\frac{44}{4.4g}$,x=8.4g
$\frac{36.5}{y}=\frac{44}{4.4g}$,y=3.65g
(1)小苏打样品中碳酸氢钠的质量分数为:$\frac{8.4g}{9.3g}$×100%=90.3%.
(2)稀盐酸的质量分数为:$\frac{3.65g}{25.1g}$×100%=14.9%
(3)$\frac{58.5}{z}=\frac{44}{4.4g}$,z=5.85g
恰好完全反应时,消耗的稀盐酸的质量为25.1g;所得溶液中溶质的质量分数为
$\frac{5.85g+9.3g-8.4g}{9.3g+25.1g-4.4g}$×100%=22.5%.
答:(1)小苏打样品中碳酸氢钠的质量分数为84%;
(2)稀盐酸的质量分数是14.9%;
(3)恰好完全反应时,所得溶液中溶质的质量分数为22.5%
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,细致地分析题意(或图表信息)等各种信息,根据找出生成二氧化碳气体的质量是正确解答本题的前提和关键.

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
表为A在不同温度下的溶解度,则在编号为①~⑤的溶液中(下列小题均填序号):
| 温度/℃ | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
(2)溶质质量分数最大是④.
(3)烧杯中没有固体存在的是①③④⑤.
| A. | CaO→CaCl2 | B. | Ca(OH)2→NaOH | C. | CaCO3→Ca(OH)2 | D. | H2SO4→FeSO4 |
| A. | NaNO3、NaCl、KNO3、(NH4)2SO4 | B. | H2SO4、HCl、AgNO3、Na2SO4 | ||
| C. | KMnO4、CuCl2、Fe2(SO4)3、NaNO3 | D. | K2SO4、NaCl、K2CO3、NaOH |