题目内容
1.铁丝燃烧时瓶中放水的目的是什么?分析 铁丝在氧气中燃烧时会有熔融的四氧化三铁溅落,据此分析解答.
解答 解:铁丝在氧气中燃烧发白光放出大量热,生成熔融的四氧化三铁,四氧化三铁高温溅落会使集气瓶炸裂,故答案为:防止生成物四氧化三铁,熔化溅落炸裂瓶底.
点评 此题考查物质与氧气反应的实验注意事项,掌握铁、硫、碳与氧气反应的注意事项是解答的关键.

练习册系列答案
相关题目
10.对下列微粒符号中“2”的理解正确的是( )
| A. | 2Cu中的“2”表示2个铜元素 | |
| B. | Fe2+中的“2”表示每个亚铁离子带有2个单位的正电荷 | |
| C. | H2S中的“2”表示两个硫原子 | |
| D. | $\stackrel{+2}{C{O}_{2}}$中化学式上方的“2”表示碳元素的化合价为2价 |
12.下列化学方程式书写正确的是( )
| A. | 2Fe+6HCl═2 Fe Cl 3+3H2↑ | B. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||
| C. | Cu+Ag(NO3)2═NO3)2+Ag | D. | Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$MgO2 |
9.能将蒸馏水、稀硫酸、稀氢氧化钠溶液鉴别出来的物质是( )
| A. | 铁丝 | B. | 澄清石灰水 | C. | 无色酚酞 | D. | 紫色石蕊 |
13.下列制备氯化铜的方法正确的是( )
| A. | 铜和稀盐酸反应 | B. | 铜和稀硫酸反应后,再加稀盐酸 | ||
| C. | 氢氧化铜和稀盐酸反应 | D. | 氧化铜和稀硫酸反应 |
10.活性氧化锌(ZnO) 是一种面向21世纪的新型高功能精细无机产品,近几年有关该物质的制备成为化工行业研究的热点.某校化学兴趣小组的同学参观了某厂用粗ZnO制备活性ZnO的生产流程,做如下探究.
Ⅰ、制备活性氧化锌
一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如图1:
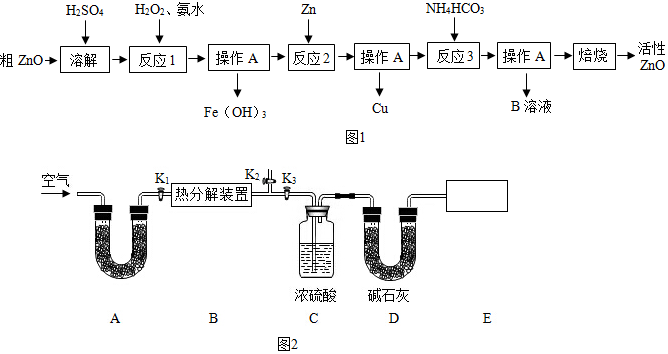
【查阅资料】①、粗ZnO中常含杂质FeO、CuO
②、反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
③、已知:几种物质沉淀时的pH如下表:
请问答下列问题:
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是增大反应物的接触面积或加快溶解速率.
(2)写出在粗ZnO样品中加硫酸发生反应的化学方程式ZnO+H2SO4═ZnSO4+H2O(选写一个).
(3)反应1的目的是将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3,为了暂不形成Cu(OH)2、Zn (OH)2,该步骤需控制溶液pH的范围是3.2~5.2.
(4)操作A的名称是过滤,该过程中使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(5)反应2中加入锌发生的反应属于置换反应(填化学反应的基本类型).
(6)B溶液的溶质是(NH4)2SO4,检验其中是否含NH4+ 的方法为可加入NaOH浓溶液加热,观察现象,如有刺激性气味的气体生成,则说明含有NH4+.
Ⅱ、测定碱式碳酸锌的化学式
该兴趣小组的同学欲写出上述流程中碱式碳酸锌焙烧生成氧化锌的化学方程式,但不知道碱式碳酸锌的化学式(xZnCO3•yZn(OH)2•zH2O),于是从该厂带回部分焙烧前的碱式碳酸锌样品在老师的指导下完成下列实验.
用下列装置测定碱式碳酸锌的化学组成,计算xZnCO3•yZn(OH)2•zH2O中x:y:z的最简比.(假设每步反应、吸收均完全)
【实验步骤】
①按图2连接好装置,并检查装置的气密性检查装置的气密性;
②在热分解装置中装入68.2g样品,打开活塞打开K1K2,,关闭K3,缓缓鼓入空气数分钟; ③称量装置C、D的质量;④关闭活塞K1,K2,打开K3,打启动热分解装置,使样品充分热解;⑤停止加热,继续通空气至装置冷却到室温; ⑥再次分别称量装置C、D的质量.
[进行实验]该小组同学按上述实验步骤进行实验,并记录了如下数据:
【实验分析及数据处理】:
(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是吸收空气中的水和二氧化碳.
(2)第⑤步继续通空气的目的是把产生的气体全部推入C、D中使之被完全吸收.
(3)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加仪器名称是干燥管,,仪器中药品是碱石灰,其作用是防止空气中的水和二氧化碳进入D中,若没有此装置,测得二氧化碳的质量偏大(填“偏大”、“偏小”或“无影响”).
(4)根据上述数据,计算xZnCO3•yZn(OH)2•zH2O中x:y:z的最简比=1:2:1,
并写出计算过程.
提示:①xZnCO3•yZn(OH)2•zH2O受热分解为ZnO、H2O、CO2 三种产物,其中
ZnCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO2↑
Zn(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ZnO+H2O
②可能用到的相对分子量:ZnCO3125 Zn(OH)2 99 ZnO 81 H2O 18 CO244
该碱式碳酸锌受热分解的化学方程式为ZnCO3•2Zn(OH)2•H2O $\frac{\underline{\;\;△\;\;}}{\;}$3ZnO+3H2O+CO2↑.
Ⅰ、制备活性氧化锌
一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如图1:

【查阅资料】①、粗ZnO中常含杂质FeO、CuO
②、反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
③、已知:几种物质沉淀时的pH如下表:
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去. | ||||
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是增大反应物的接触面积或加快溶解速率.
(2)写出在粗ZnO样品中加硫酸发生反应的化学方程式ZnO+H2SO4═ZnSO4+H2O(选写一个).
(3)反应1的目的是将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3,为了暂不形成Cu(OH)2、Zn (OH)2,该步骤需控制溶液pH的范围是3.2~5.2.
(4)操作A的名称是过滤,该过程中使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(5)反应2中加入锌发生的反应属于置换反应(填化学反应的基本类型).
(6)B溶液的溶质是(NH4)2SO4,检验其中是否含NH4+ 的方法为可加入NaOH浓溶液加热,观察现象,如有刺激性气味的气体生成,则说明含有NH4+.
Ⅱ、测定碱式碳酸锌的化学式
该兴趣小组的同学欲写出上述流程中碱式碳酸锌焙烧生成氧化锌的化学方程式,但不知道碱式碳酸锌的化学式(xZnCO3•yZn(OH)2•zH2O),于是从该厂带回部分焙烧前的碱式碳酸锌样品在老师的指导下完成下列实验.
用下列装置测定碱式碳酸锌的化学组成,计算xZnCO3•yZn(OH)2•zH2O中x:y:z的最简比.(假设每步反应、吸收均完全)
【实验步骤】
①按图2连接好装置,并检查装置的气密性检查装置的气密性;
②在热分解装置中装入68.2g样品,打开活塞打开K1K2,,关闭K3,缓缓鼓入空气数分钟; ③称量装置C、D的质量;④关闭活塞K1,K2,打开K3,打启动热分解装置,使样品充分热解;⑤停止加热,继续通空气至装置冷却到室温; ⑥再次分别称量装置C、D的质量.
[进行实验]该小组同学按上述实验步骤进行实验,并记录了如下数据:
| 装置C的质量(/g) | 装置D的质量(/g) | |
| 实验前 | 198.4 | 235.7 |
| 实验后 | 209.2 | 244.5 |
(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是吸收空气中的水和二氧化碳.
(2)第⑤步继续通空气的目的是把产生的气体全部推入C、D中使之被完全吸收.
(3)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加仪器名称是干燥管,,仪器中药品是碱石灰,其作用是防止空气中的水和二氧化碳进入D中,若没有此装置,测得二氧化碳的质量偏大(填“偏大”、“偏小”或“无影响”).
(4)根据上述数据,计算xZnCO3•yZn(OH)2•zH2O中x:y:z的最简比=1:2:1,
并写出计算过程.
提示:①xZnCO3•yZn(OH)2•zH2O受热分解为ZnO、H2O、CO2 三种产物,其中
ZnCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO2↑
Zn(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ZnO+H2O
②可能用到的相对分子量:ZnCO3125 Zn(OH)2 99 ZnO 81 H2O 18 CO244
该碱式碳酸锌受热分解的化学方程式为ZnCO3•2Zn(OH)2•H2O $\frac{\underline{\;\;△\;\;}}{\;}$3ZnO+3H2O+CO2↑.
11.推理是化学学习中常用的思维方法.下列推断不正确的是( )
| A. | 碱溶液一定呈碱性,呈碱性的溶液不一定是碱溶液 | |
| B. | 置换反应一定有单质和化合物生成,有单质和化合物生成的反应不一定是置换反应 | |
| C. | 酸雨一定呈现酸性,呈现酸性的雨不一定是酸雨 | |
| D. | 单质一定是含一种元素的纯净物,纯净物含有一种元素不一定是单质 |
 某同学用如图的装置测定空气中氧气的体积分数.
某同学用如图的装置测定空气中氧气的体积分数.